Page 117 - LAJU REAKSI: STEM-PjBL BERBASIS AUGMENTED REALITY TERINTEGRASI GREEN CHEMISTRY_Neat
P. 117
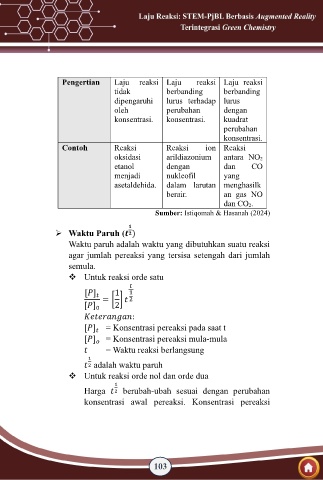
Pengertian Laju reaksi Laju reaksi Laju reaksi
tidak berbanding berbanding
dipengaruhi lurus terhadap lurus
oleh perubahan dengan
konsentrasi. konsentrasi. kuadrat
perubahan
konsentrasi.
Contoh Reaksi Reaksi ion Reaksi
oksidasi arildiazonium antara NO2
etanol dengan dan CO
menjadi nukleofil yang
asetaldehida. dalam larutan menghasilk
berair. an gas NO
dan CO2.
Sumber: Istiqomah & Hasanah (2024)
➢ Waktu Paruh ( ሻ
Waktu paruh adalah waktu yang dibutuhkan suatu reaksi
agar jumlah pereaksi yang tersisa setengah dari jumlah
semula.
❖ Untuk reaksi orde satu
[ ] = [ ] 2
1
1
[ ] 0 2
:
[ ] = Konsentrasi pereaksi pada saat t
[ ] = Konsentrasi pereaksi mula-mula
= Waktu reaksi berlangsung
1
2 adalah waktu paruh
❖ Untuk reaksi orde nol dan orde dua
1
Harga 2 berubah-ubah sesuai dengan perubahan
konsentrasi awal pereaksi. Konsentrasi pereaksi
103