Page 28 - E-Modul Ikatan Kimia Berbasis Problem based Learning Terintegrasi TPACK untk Fase F SMA
P. 28
E-Modul Ikatan Kimia Berbasis PBL Terintegrasi TPACK Untuk Fase F SMA
Pertanyaan Unsur golongan VIII A merupakan unsur yang stabil dan
Lantas mengapa atom digolongan setiap unsur pada golongan tersebut dapat ditemukan
gas mulia stabil sedangkan atom
yang lain tidak ? bebas di alam tanpa berikatan dengan unsur lain, hal
Apa yang menjadi acuan kapan suatu tersebutlah yang membuatnya disebut golongan gas
atom dikatakan stabil atau tidak ? mulia.
Setelah mengamati Sistem Periodik Unsur, Kossel dan Lewis berpendapat bahwa pada
dasarnya, sifat dari suatu unsur ditentukan oleh bagaimana elektron di dalam atomnya
tersusun. Berdasarkan teori tersebut maka ilmuan mencari hubungan antara konfigurasi
elektron dengan sifat kestabilan dari suatu atom.
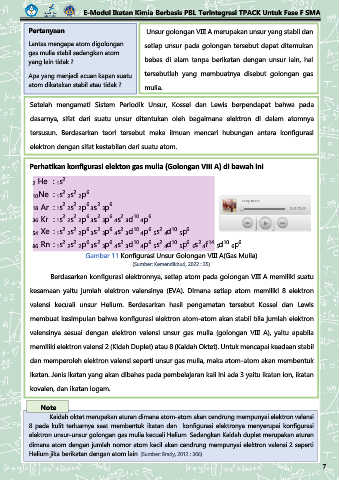
Perhatikan konfigurasi elekton gas mulia (Golongan VIII A) di bawah ini
2
2 He : 1s
2
6
2
10Ne : 1s 2s 2p
2
6
2
2
6
18 Ar : 1s 2s 2p 3s 3p
10
6
2
2
6
6
36 Kr : 1s 2s 2p 3s 3p 4s 3d 4p
2
2
2
6
6
2
10
6
2
10
6
2
2
54 Xe : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p
10
14
6
2
2
10
6
2
6
2
2
6
6
10
2
86 Rn : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p
Gambar 11 Konfigurasi Unsur Golongan VIII A(Gas Mulia)
(Sumber: Kemendikbud, 2022 : 35)
Berdasarkan konfigurasi elektronnya, setiap atom pada golongan VIII A memiliki suatu
kesamaan yaitu jumlah elektron valensinya (EVA). Dimana setiap atom memiliki 8 elektron
valensi kecuali unsur Helium. Berdasarkan hasil pengamatan tersebut Kossel dan Lewis
membuat kesimpulan bahwa konfigurasi elektron atom-atom akan stabil bila jumlah elektron
valensinya sesuai dengan elektron valensi unsur gas mulia (golongan VIII A), yaitu apabila
memiliki elektron valensi 2 (Kidah Duplet) atau 8 (Kaidah Oktet). Untuk mencapai keadaan stabil
dan memperoleh elektron valensi seperti unsur gas mulia, maka atom-atom akan membentuk
ikatan. Jenis ikatan yang akan dibahas pada pembelajaran kali ini ada 3 yaitu ikatan ion, ikatan
kovalen, dan ikatan logam.
Note
Kaidah oktet merupakan aturan dimana atom-atom akan cendrung mempunyai elektron valensi
8 pada kulit terluarnya saat membentuk ikatan dan konfigurasi elektronya menyerupai konfigurasi
elektron unsur-unsur golongan gas mulia kecuali Helium. Sedangkan Kaidah duplet merupakan aturan
dimana atom dengan jumlah nomor atom kecil akan cendrung mempunyai elektron valensi 2 seperti
Helium jika berikatan dengan atom lain. (Sumber: Brady, 2012 : 366)
7