Page 33 - E-MODULE ASAM BASA BY HAZMI FAUZI
P. 33
XI
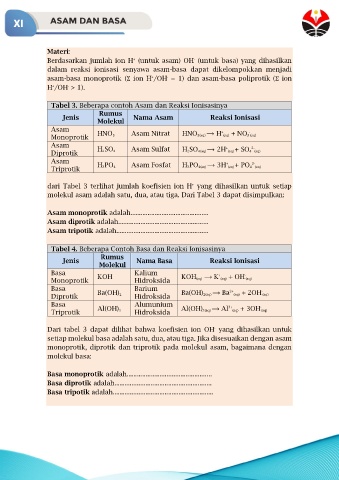
Materi:
Berdasarkan jumlah ion H (untuk asam) OH (untuk basa) yang dihasilkan
-
+
dalam reaksi ionisasi senyawa asam-basa dapat dikelompokkan menjadi
asam-basa monoprotik (Ʃ ion H /OH = 1) dan asam-basa poliprotik (Ʃ ion
-
+
H /OH > 1).
-
+
Tabel 3. Beberapa contoh Asam dan Reaksi Ionisasinya
Rumus
Jenis Nama Asam Reaksi Ionisasi
Molekul
Asam HNO 3 Asam Nitrat HNO 3(aq) ⟶ H (aq) + NO 3 (aq)
-
+
Monoprotik
Asam H 2SO 4 Asam Sulfat H 2SO 4(aq) ⟶ 2H (aq) + SO 4 (aq)
+
2-
Diprotik
Asam H 3PO 4 Asam Fosfat H 3PO 4(aq) ⟶ 3H (aq) + PO 4 (aq)
3-
+
Triprotik
dari Tabel 3 terlihat jumlah koefisien ion H yang dihasilkan untuk setiap
+
molekul asam adalah satu, dua, atau tiga. Dari Tabel 3 dapat disimpulkan:
Asam monoprotik adalah.............................................
Asam diprotik adalah....................................................
Asam tripotik adalah.....................................................
Tabel 4. Beberapa Contoh Basa dan Reaksi Ionisasinya
Rumus
Jenis Nama Basa Reaksi Ionisasi
Molekul
Basa Kalium + -
Monoprotik KOH Hidroksida KOH (aq) ⟶ K (aq) + OH (aq)
Basa Barium 2+ -
Diprotik Ba(OH) 2 Hidroksida Ba(OH) 2(aq) ⟶ Ba (aq) + 2OH (aq)
Basa Al(OH) 3 Alumunium Al(OH) 3(aq) ⟶ Al 3+ -
Triprotik Hidroksida (aq) + 3OH (aq)
Dari tabel 3 dapat dilihat bahwa koefisien ion OH yang dihasilkan untuk
-
setiap molekul basa adalah satu, dua, atau tiga. Jika disesuaikan dengan asam
monoprotik, diprotik dan triprotik pada molekul asam, bagaimana dengan
molekul basa:
Basa monoprotik adalah.................................................
Basa diprotik adalah........................................................
Basa tripotik adalah..........................................................