Page 88 - KIMIA SMA KELAS XI BERBASIS PjBl
P. 88
[𝐻𝐴] = √ 𝐾𝑤 [𝐴−] 𝐾𝑎 .𝐾𝑏
Dari tetapan ionisasi asam lemah diperoleh:
[H+] = 𝐾𝑎. [𝐻𝐴] [𝐴−]
Sehingga:
[H+] = Ka . √ 𝐾𝑤
𝐾𝑎 .𝐾𝑏
[H+] = Kw 1 . Ka 1 . Kb 1 222
Ph = 1 (PKw . PKa . PKb) 2
C. Kelarutan (Solubility) dan Tetapan Hasil Kali Kelarutan (Ksp)
Pada pembahasaan sebelumnya kita sudah membahas materi tentang garam, dan
kita sudah mengetahui bahwa garam larut dalam air dan membentuk ion-ionnya .
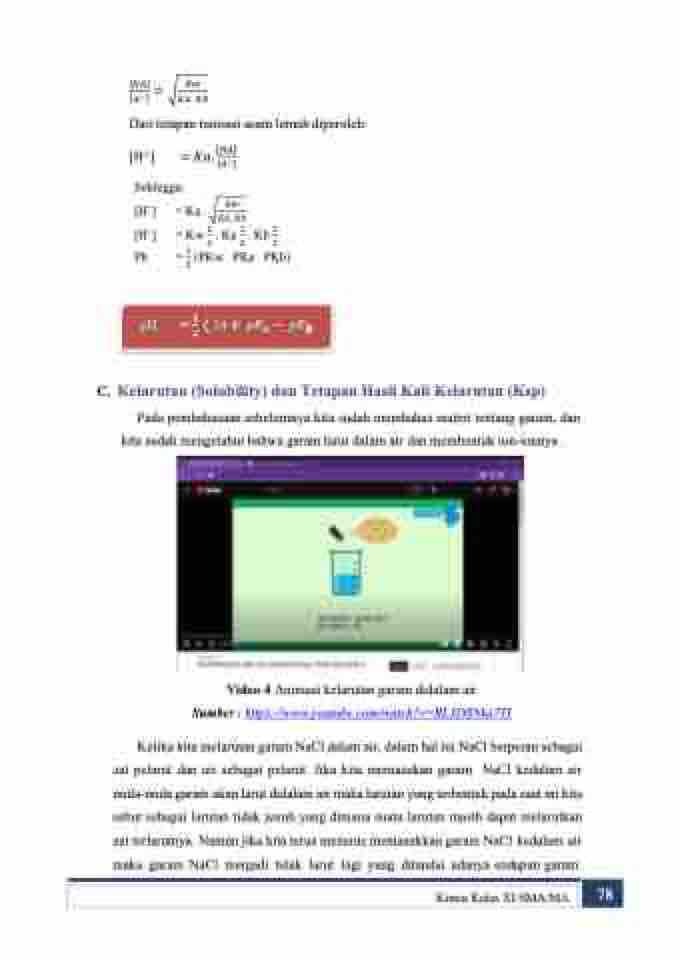
Video 4 Animasi kelarutan garam didalam air Sumber : https://www.youtube.com/watch?v=BL3DSNka7TI
Ketika kita melarutan garam NaCl dalam air, dalam hal ini NaCl berperan sebagai zat pelarut dan air sebagai pelarut. Jika kita memasukan garam NaCl kedalam air mula-mula garam akan larut didalam air maka larutan yang terbentuk pada saat ini kita sebut sebagai larutan tidak jenuh yang dimana suatu larutan masih dapat melarutkan zat terlarutnya. Namun jika kita terus menerus memasukkan garam NaCl kedalam air maka garam NaCl menjadi tidak larut lagi yang ditandai adanya endapan garam.
Kimia Kelas XI SMA/MA
78