Page 202 - BUKU AJAR BIOKIMIA 1 K5FN
P. 202
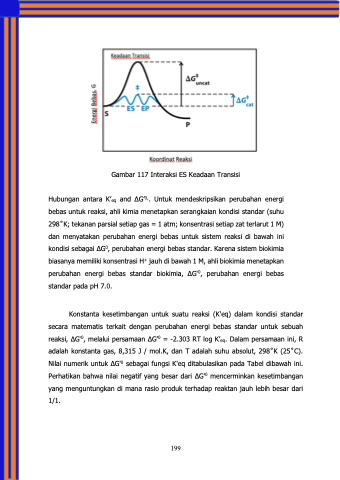
Gambar 117 Interaksi ES Keadaan Transisi
Hubungan antara K’eq and ∆G’0,. Untuk mendeskripsikan perubahan energi bebas untuk reaksi, ahli kimia menetapkan serangkaian kondisi standar (suhu 298˚K; tekanan parsial setiap gas = 1 atm; konsentrasi setiap zat terlarut 1 M) dan menyatakan perubahan energi bebas untuk sistem reaksi di bawah ini kondisi sebagai ∆G0, perubahan energi bebas standar. Karena sistem biokimia biasanya memiliki konsentrasi H+ jauh di bawah 1 M, ahli biokimia menetapkan perubahan energi bebas standar biokimia, ∆G'0, perubahan energi bebas standar pada pH 7.0.
Konstanta kesetimbangan untuk suatu reaksi (K'eq) dalam kondisi standar secara matematis terkait dengan perubahan energi bebas standar untuk sebuah reaksi, ∆G'0, melalui persamaan ∆G’0 = -2.303 RT log K’eq. Dalam persamaan ini, R adalah konstanta gas, 8,315 J / mol.K, dan T adalah suhu absolut, 298˚K (25˚C). Nilai numerik untuk ∆G'0 sebagai fungsi K'eq ditabulasikan pada Tabel dibawah ini. Perhatikan bahwa nilai negatif yang besar dari ∆G'0 mencerminkan kesetimbangan yang menguntungkan di mana rasio produk terhadap reaktan jauh lebih besar dari 1/1.
199