Page 55 - E-Modul Sifat Koligatif Larutan Berbasis SETS new
P. 55
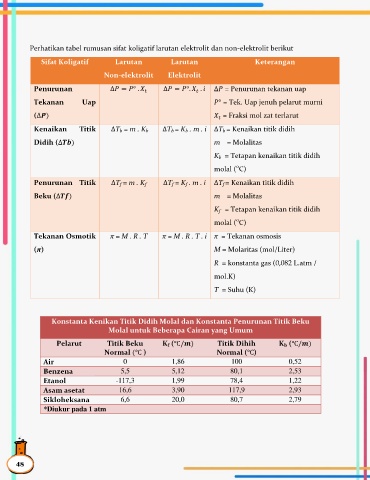
Perhatikan tabel rumusan sifat koligatif larutan elektrolit dan non-elektrolit berikut
Sifat Koligatif Larutan Larutan Keterangan
Non-elektrolit Elektrolit
Penurunan ∆ = ° . ∆ = °. . ∆ = Penurunan tekanan uap
Tekanan Uap ° = Tek. Uap jenuh pelarut murni
(∆ ) = Fraksi mol zat terlarut
Kenaikan Titik ∆T b = m . K b ∆T b = K b . m . i ∆T b = Kenaikan titik didih
Didih (∆ ) m = Molalitas
K b = Tetapan kenaikan titik didih
o
molal ( C)
Penurunan Titik ∆T f = m . K f ∆T f = K f . m . i ∆T f = Kenaikan titik didih
Beku (∆ ) m = Molalitas
K f = Tetapan kenaikan titik didih
o
molal ( C)
Tekanan Osmotik π = M . R . T π = M . R . T . i π = Tekanan osmosis
(π) M = Molaritas (mol/Liter)
R = konstanta gas (0,082 L.atm /
mol.K)
T = Suhu (K)
Konstanta Kenikan Titik Didih Molal dan Konstanta Penurunan Titik Beku
Molal untuk Beberapa Cairan yang Umum
Pelarut Titik Beku K f ( ) Titik Dihih K b ( )
Normal ( ) Normal ( )
Air 0 1,86 100 0,52
Benzena 5,5 5,12 80,1 2,53
Etanol -117,3 1,99 78,4 1,22
Asam asetat 16,6 3,90 117,9 2,93
Sikloheksana 6,6 20,0 80,7 2,79
*Diukur pada 1 atm
48