Page 28 - E-BOOK KONSEP REDOKS
P. 28
Oksidator merupakan spesi yang mengalami penurunan bilangan
oksidasi
Reduktor merupakan spesi yang mengalami kenaikan bilangan
oksidasi
Dengan menggunakan konsep perubahan bilangan oksidasi maka reaksi
reduksi dan oksidasi dari suatu reaksi redoks yang rumit dapat ditentukan.
Contoh :
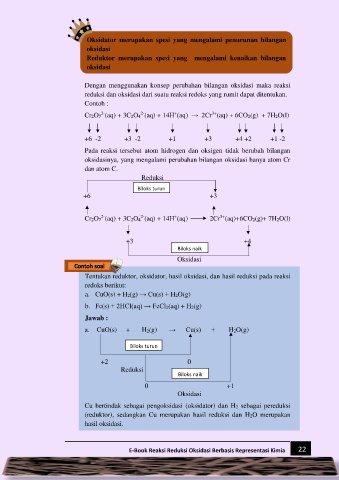
3+
+
2-
2-
Cr2O7 (aq) + 3C2O4 (aq) + 14H (aq) → 2Cr (aq) + 6CO2(g) + 7H2O(l)
+6 -2 +3 -2 +1 +3 +4 +2 +1 -2
Pada reaksi tersebut atom hidrogen dan oksigen tidak berubah bilangan
oksidasinya, yang mengalami perubahan bilangan oksidasi hanya atom Cr
dan atom C.
Reduksi
Biloks turun
+6 +3
3+
2-
2-
+
Cr2O7 (aq) + 3C2O4 (aq) + 14H (aq) 2Cr (aq)+6CO2(g)+ 7H2O(l)
+3 +4
Biloks naik
Oksidasi
Tentukan reduktor, oksidator, hasil oksidasi, dan hasil reduksi pada reaksi
redoks berikut:
a. CuO(s) + H2(g) → Cu(s) + H2O(g)
b. Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
Jawab :
a. CuO(s) + H2(g) → Cu(s) + H2O(g)
Biloks turun
+2 0
Reduksi
Biloks naik
0 +1
Oksidasi
Cu bertindak sebagai pengoksidasi (oksidator) dan H2 sebagai pereduksi
(reduktor), sedangkan Cu merupakan hasil reduksi dan H2O merupakan
hasil oksidasi.
E-Book Reaksi Reduksi Oksidasi Berbasis Representasi Kimia 22