Page 27 - E-BOOK KONSEP REDOKS
P. 27
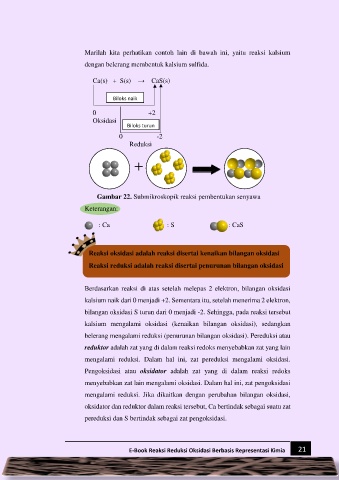
Marilah kita perhatikan contoh lain di bawah ini, yaitu reaksi kalsium
dengan belerang membentuk kalsium sulfida.
Ca(s) + S(s) → CaS(s)
Biloks naik
0 +2
Oksidasi
Biloks turun
0 -2
Reduksi
Gambar 22. Submikroskopik reaksi pembentukan senyawa
Keterangan:
: Ca : S : CaS
Reaksi oksidasi adalah reaksi disertai kenaikan bilangan oksidasi
Reaksi reduksi adalah reaksi disertai penurunan bilangan oksidasi
Berdasarkan reaksi di atas setelah melepas 2 elektron, bilangan oksidasi
kalsium naik dari 0 menjadi +2. Sementara itu, setelah menerima 2 elektron,
bilangan oksidasi S turun dari 0 menjadi -2. Sehingga, pada reaksi tersebut
kalsium mengalami oksidasi (kenaikan bilangan oksidasi), sedangkan
belerang mengalami reduksi (penurunan bilangan oksidasi). Pereduksi atau
reduktor adalah zat yang di dalam reaksi redoks menyebabkan zat yang lain
mengalami reduksi. Dalam hal ini, zat pereduksi mengalami oksidasi.
Pengoksidasi atau oksidator adalah zat yang di dalam reaksi redoks
menyebabkan zat lain mengalami oksidasi. Dalam hal ini, zat pengoksidasi
mengalami reduksi. Jika dikaitkan dengan perubahan bilangan oksidasi,
oksidator dan reduktor dalam reaksi tersebut, Ca bertindak sebagai suatu zat
pereduksi dan S bertindak sebagai zat pengoksidasi.
E-Book Reaksi Reduksi Oksidasi Berbasis Representasi Kimia 21