Page 23 - E-BOOK KONSEP REDOKS
P. 23
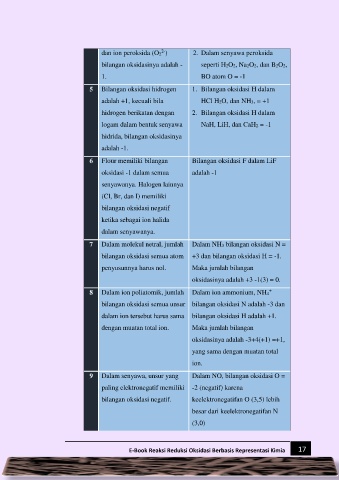
2-
dan ion peroksida (O2 ) 2. Dalam senyawa peroksida
bilangan oksidasinya adalah - seperti H2O2, Na2O2, dan B2O2,
1. BO atom O = -1
5 Bilangan oksidasi hidrogen 1. Bilangan oksidasi H dalam
adalah +1, kecuali bila HCl H2O, dan NH3, = +1
hidrogen berikatan dengan 2. Bilangan oksidasi H dalam
logam dalam bentuk senyawa NaH, LiH, dan CaH2 = -1
hidrida, bilangan oksidasinya
adalah -1.
6 Flour memiliki bilangan Bilangan oksidasi F dalam LiF
oksidasi -1 dalam semua adalah -1
senyawanya. Halogen lainnya
(Cl, Br, dan I) memiliki
bilangan oksidasi negatif
ketika sebagai ion halida
dalam senyawanya.
7 Dalam molekul netral, jumlah Dalam NH3 bilangan oksidasi N =
bilangan oksidasi semua atom +3 dan bilangan oksidasi H = -1.
penyusunnya harus nol. Maka jumlah bilangan
oksidasinya adalah +3 -1(3) = 0.
+
8 Dalam ion poliatomik, jumlah Dalam ion ammonium, NH4
bilangan oksidasi semua unsur bilangan oksidasi N adalah -3 dan
dalam ion tersebut harus sama bilangan oksidasi H adalah +1.
dengan muatan total ion. Maka jumlah bilangan
oksidasinya adalah -3+4(+1) =+1,
yang sama dengan muatan total
ion.
9 Dalam senyawa, unsur yang Dalam NO, bilangan oksidasi O =
paling elektronegatif memiliki -2 (negatif) karena
bilangan oksidasi negatif. keelektronegatifan O (3,5) lebih
besar dari keelektronegatifan N
(3,0)
E-Book Reaksi Reduksi Oksidasi Berbasis Representasi Kimia 17