Page 24 - E-MODUL SIFAT ASAM BASA SENYAWA ORGANIK_ANDRA MEISANTRY ASSARI_F1062181002_FKIP UNTAN
P. 24
Nilai pK a pada Tabel 1. merupakan nilai paling akurat karena dapat diukur di
dalam larutan berair. Berdasarkan data pada Tabel 1. dapat disimpulkan bahwa
semakin kecil pK a basa konjugasinya, maka semakin kuat asamnya. Begitu sebaliknya,
semakin besar pK a asam konjugasinya, maka semakin kuat basanya.
Faktor-faktor utama yang mempengaruhi kestabilan anion (A ), dan kuat asam
-
-
HA, antara lain: 1) keelektronegatifan; 2) ukuran anion (A ); 3) hibridisasi; 4) efek
induktif; 5) stabilisasi-resonansi; dan 6) solvasi (Fessenden & Fessenden, 1986).
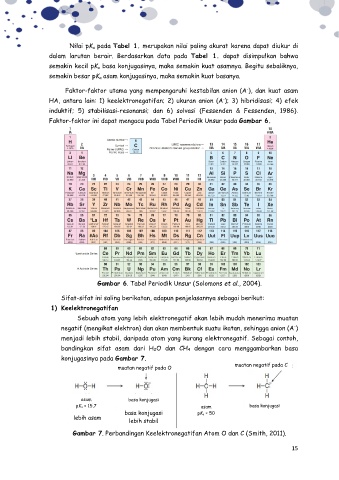
Faktor-faktor ini dapat mengacu pada Tabel Periodik Unsur pada Gambar 6.
Gambar 6. Tabel Periodik Unsur (Solomons et al., 2004).
Sifat-sifat ini saling berikatan, adapun penjelasannya sebagai berikut:
1) Keelektronegatifan
Sebuah atom yang lebih elektronegatif akan lebih mudah menerima muatan
-
negatif (mengikat elektron) dan akan membentuk suatu ikatan, sehingga anion (A )
menjadi lebih stabil, daripada atom yang kurang elektronegatif. Sebagai contoh,
bandingkan sifat asam dari H2O dan CH4 dengan cara menggambarkan basa
konjugasinya pada Gambar 7.
muatan negatif pada O muatan negatif pada C
asam basa konjugasi
pK a = 15,7 asam basa konjugasi
basa konjugasi basa konjugasi pK a = 50
lebih asam
lebih stabil
Gambar 7. Perbandingan Keelektronegatifan Atom O dan C (Smith, 2011).
15