Page 97 - E-modul Anorganik Satu semester
P. 97
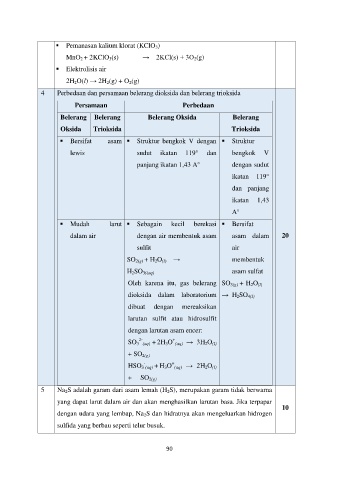
Pemanasan kalium klorat (KClO 3)
MnO 2 + 2KClO 3(s) → 2KCl(s) + 3O 2(g)
Elektrolisis air
2H 2O(l) → 2H 2(g) + O 2(g)
4 Perbedaan dan persamaan belerang dioksida dan belerang trioksida
Persamaan Perbedaan
Belerang Belerang Belerang Oksida Belerang
Oksida Trioksida Trioksida
Bersifat asam Struktur bengkok V dengan Struktur
lewis sudut ikatan 119° dan bengkok V
panjang ikatan 1,43 A° dengan sudut
ikatan 119°
dan panjang
ikatan 1,43
A°
Mudah larut Sebagain kecil berekasi Bersifat
dalam air dengan air membentuk asam asam dalam 20
sulfit air
SO 2(g) + H 2O (l) → membentuk
H 2SO 3((aq) asam sulfat
Oleh karena itu, gas belerang SO 3(g) + H 2O (l)
dioksida dalam laboratorium → H 2SO 4(l)
dibuat dengan mereaksikan
larutan sulfit atau hidrosulfit
dengan larutan asam encer:
+
2-
SO 3 (aq) + 2H 3O (aq) → 3H 2O (l)
+ SO 2(g)
-
+
HSO 3 (aq) + H 3O (aq) → 2H 2O (l)
+ SO 2(g)
5 Na 2S adalah garam dari asam lemah (H 2S), merupakan garam tidak berwarna
yang dapat larut dalam air dan akan menghasilkan larutan basa. Jika terpapar
10
dengan udara yang lembap, Na 2S dan hidratnya akan mengeluarkan hidrogen
sulfida yang berbau seperti telur busuk.
90