Page 100 - E-modul Anorganik Satu semester
P. 100
tanda positif biasanya digunakan. Agar konsisten dengan perubahan entalpi, sebenarnya tanda
-1
negatif yang lebih tepat Afinitas elektron klorin (348,5 kJmol ) adalah yang terbesar dar
-1
fluorin (332,6 kJmol ) nilainya terletak di antara afinitas elektron klorin dan bromin (324,7
-¹
kJmol ).
Energi ionisasi unsur-unsur halogen relatif tinggi disbanding dengan energi ionisasi
unsur lain yang seperioda. Tingginya energi ionisasi ini merupakan petunjuk bahwa unsur-
unsur halogen sangat sukar melepaskan elektron dan membentuk ion positf. Energi ionisasi F
sangat besar dibanding unsur lainnya dalam satu golongan karena ukuran atom F yang begitu
kecil. Nilai energi ionisasi unsur halogen berkurang dari F ke I. Elektronegativitas halogen
berkurang dari F ke At, sementara jari-jari ionik dan jari-jari kovalennya semakin bertambah
dari F ke At.
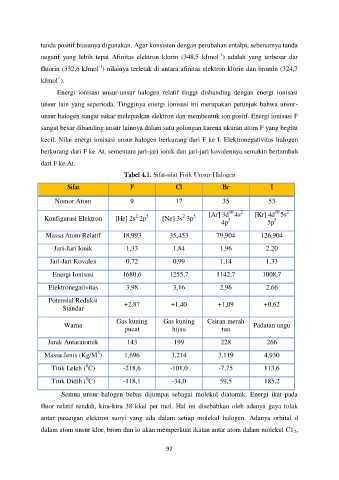
Tabel 4.1. Sifat-sifat Fisik Unsur Halogen
Sifat F Cl Br I
Nomor Atom 9 17 35 53
2
10
10
2
5
2
2
Konfigurasi Elektron [He] 2s 2p 5 [Ne] 3s 3p [Ar] 3d 4s [Kr] 4d 5s
5
5
4p 5p
Massa Atom Relatif 18,993 35,453 79,904 126,904
Jari-Jari Ionik 1,33 1,84 1,96 2,20
Jari-Jari Kovalen 0,72 0,99 1,14 1,33
Energi Ionisasi 1680,6 1255,7 1142,7 1008,7
Elektronegativitas 3,98 3,16 2,96 2,66
Potensial Reduksi
Standar +2,87 +1,40 +1,09 +0,62
Gas kuning Gas kuning Cairan merah
Warna Padatan ungu
pucat hijau tua
Jarak Antaratomik 143 199 228 266
3
Massa Jenis (Kg/M ) 1,696 3,214 3,119 4,930
0
Titik Leleh ( C) -218,6 -101,0 -7,75 113,6
0
Titik Didih ( C) -118,1 -34,0 59,5 185,2
Semua unsur halogen bebas dijumpai sebagai molekul diatomik. Energi ikat pada
fluor relatif rendah, kira-kira 38 kkal per mol. Hal ini disebabkan oleh adanya gaya tolak
antar pasangan elektron sunyi yang ada dalam setiap molekul halogen. Adanya orbital d
dalam atom unsur klor, brom dan io akan memperkuat ikatan antar atom dalam molekul C1 2,
92