Page 4 - BAB V - LAJU REAKSI
P. 4
LAJU REAKSI
Kembang api merupakan suatu fenomena yang biasa terlihat pada pelaksanaan
festival-festival. Ketika kita menyaksikan pertunjukkan kembang api di malam hari,
kembang api akan menimbulkan cahaya yang indah, tetapi hilang dalam beberapa detik
saja. tahukah Anda, jenis reaksi kimia apa yang terlibat dalam proses pertunjukkan
kembang api tersebut?. Apakah yang mempengaruhi cepat atau lambatnya suatu reaksi
pembakaran kembang api berlangsung? Untuk mengetahui peristiwa tersebut, fenomena
ini akan dibahas dalam bab laju reaksi
5.1 Konsep Laju Reaksi
Laju menyatakan seberapa cepat atau seberapa lambat suatu proses berlangsung.
Laju juga menyatakan besarnya perubahan yang terjadi dalam satu satuan waktu. Reaksi
kimia adalah proses perubahan zat pereaksi menjadi produk, seiring dengan
bertambahnya waktu reaksi, maka jumlah zat peraksi semakin sedikit, sedangkan produk
semakin banyak. Maka definisi dari laju reaksi kimia adalah perubahan konsentrasi
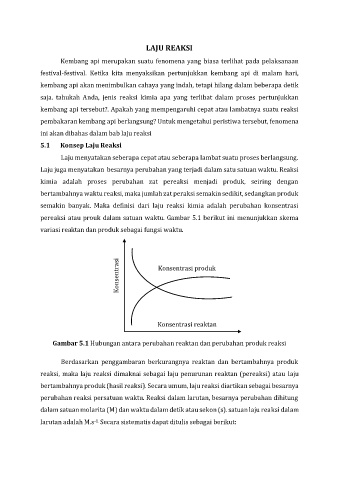
pereaksi atau prouk dalam satuan waktu. Gambar 5.1 berikut ini menunjukkan skema
variasi reaktan dan produk sebagai fungsi waktu.
Konsentrasi produk
Konsentrasi
Konsentrasi reaktan
Gambar 5.1 Hubungan antara perubahan reaktan dan perubahan produk reaksi
Berdasarkan penggambaran berkurangnya reaktan dan bertambahnya produk
reaksi, maka laju reaksi dimaknai sebagai laju penurunan reaktan (pereaksi) atau laju
bertambahnya produk (hasil reaksi). Secara umum, laju reaksi diartikan sebagai besarnya
perubahan reaksi persatuan waktu. Reaksi dalam larutan, besarnya perubahan dihitung
dalam satuan molarita (M) dan waktu dalam detik atau sekon (s). satuan laju reaksi dalam
-1.
larutan adalah M.s Secara sistematis dapat ditulis sebagai berikut: