Page 20 - Ebook Rayhan Jamilah
P. 20
Contoh:
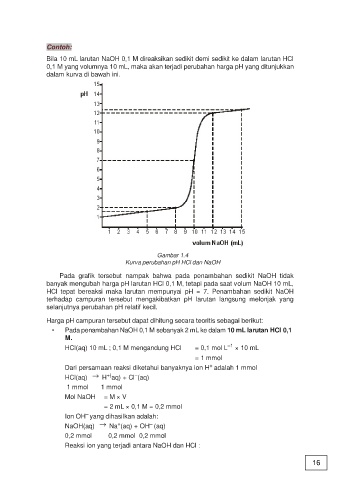
Bila 10 mL larutan NaOH 0,1 M direaksikan sedikit demi sedikit ke dalam larutan HCl
0,1 M yang volumnya 10 mL, maka akan terjadi perubahan harga pH yang ditunjukkan
dalam kurva di bawah ini.
Gambar 1.4
Kurva perubahan pH HCl dan NaOH
Pada grafik tersebut nampak bahwa pada penambahan sedikit NaOH tidak
banyak mengubah harga pH larutan HCl 0,1 M, tetapi pada saat volum NaOH 10 mL,
HCl tepat bereaksi maka larutan mempunyai pH = 7. Penambahan sedikit NaOH
terhadap campuran tersebut mengakibatkan pH larutan langsung melonjak yang
selanjutnya perubahan pH relatif kecil.
Harga pH campuran tersebut dapat dihitung secara teoritis sebagai berikut:
• Pada penambahan NaOH 0,1 M sebanyak 2 mL ke dalam 10 mL larutan HCl 0,1
M.
HCl(aq) 10 mL ; 0,1 M mengandung HCl = 0,1 mol L –1 × 10 mL
= 1 mmol
+
Dari persamaan reaksi diketahui banyaknya ion H adalah 1 mmol
+(
–
HCl(aq) H aq) + Cl (aq)
1 mmol 1 mmol
Mol NaOH = M × V
= 2 mL × 0,1 M = 0,2 mmol
–
Ion OH yang dihasilkan adalah:
–
+
NaOH(aq) Na (aq) + OH (aq)
0,2 mmol 0,2 mmol 0,2 mmol
Reaksi ion yang terjadi antara NaOH dan HCl :
16