Page 60 - biologia 1 Maria Eugenia Mendez Rosales
P. 60
Biología básica I
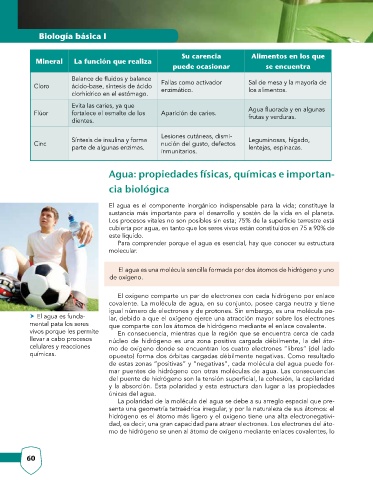
Su carencia Alimentos en los que
Mineral La función que realiza
puede ocasionar se encuentra
Balance de fluidos y balance
Cloro ácido-base, síntesis de ácido Fallas como activador Sal de mesa y la mayoría de
los alimentos.
enzimático.
clorhídrico en el estómago.
Evita las caries, ya que
Flúor fortalece el esmalte de los Aparición de caries. Agua fluorada y en algunas
frutas y verduras.
dientes.
Lesiones cutáneas, dismi-
Síntesis de insulina y forma Leguminosas, hígado,
Cinc nución del gusto, defectos
parte de algunas enzimas. lentejas, espinacas.
inmunitarios.
Agua: propiedades físicas, químicas e importan-
cia biológica
El agua es el componente inorgánico indispensable para la vida; constituye la
sustancia más importante para el desarrollo y sostén de la vida en el planeta.
Los procesos vitales no son posibles sin esta; 75% de la superficie terrestre está
cubierta por agua, en tanto que los seres vivos están constituidos en 75 a 90% de
este líquido.
Para comprender porque el agua es esencial, hay que conocer su estructura
molecular.
El agua es una molécula sencilla formada por dos átomos de hidrógeno y uno
de oxígeno.
El oxígeno comparte un par de electrones con cada hidrógeno por enlace
covalente. La molécula de agua, en su conjunto, posee carga neutra y tiene
igual número de electrones y de protones. Sin embargo, es una molécula po-
† El agua es funda- lar, debido a que el oxígeno ejerce una atracción mayor sobre los electrones
mental pata los seres que comparte con los átomos de hidrógeno mediante el enlace covalente.
vivos porque les permite En consecuencia, mientras que la región que se encuentra cerca de cada
llevar a cabo procesos núcleo de hidrógeno es una zona positiva cargada débilmente, la del áto-
celulares y reacciones mo de oxígeno donde se encuentran los cuatro electrones “libres” (del lado
químicas. opuesto) forma dos órbitas cargadas débilmente negativas. Como resultado
de estas zonas “positivas” y “negativas”, cada molécula del agua puede for-
mar puentes de hidrógeno con otras moléculas de agua. Las consecuencias
del puente de hidrógeno son la tensión superficial, la cohesión, la capilaridad
y la absorción. Esta polaridad y esta estructura dan lugar a las propiedades
únicas del agua.
La polaridad de la molécula del agua se debe a su arreglo espacial que pre-
senta una geometría tetraédrica irregular, y por la naturaleza de sus átomos: el
hidrógeno es el átomo más ligero y el oxígeno tiene una alta electronegativi-
dad, es decir, una gran capacidad para atraer electrones. Los electrones del áto-
mo de hidrógeno se unen al átomo de oxígeno mediante enlaces covalentes, lo
60