Page 60 - E-MODUL PEMBELAJARAN TERMOKIMIA BERBASIS PBL
P. 60
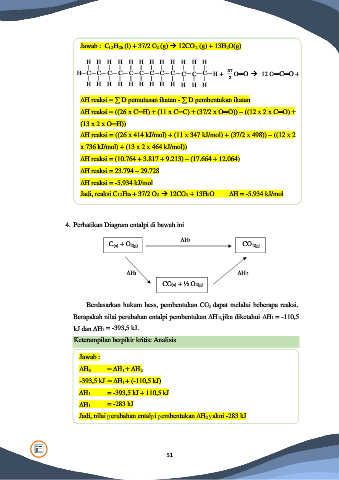
Jawab : C12H26 (l) + 37/2 O2 (g) → 12CO2 (g) + 13H2O(g)
H H H H H H H H H H H H
37
H C C C C C C C C C C C C H + 2 O═O → 12 O═C═O +
H H H H H H H H H H H H 13 O─H─O
∆H reaksi = ∑ D pemutusan ikatan - ∑ D pembentukan ikatan
∆H reaksi = ((26 x C─H) + (11 x C─C) + (37/2 x O═O)) – ((12 x 2 x C═O) +
(13 x 2 x O─H))
∆H reaksi = ((26 x 414 kJ/mol) + (11 x 347 kJ/mol) + (37/2 x 498)) – ((12 x 2
x 736 kJ/mol) + (13 x 2 x 464 kJ/mol))
∆H reaksi = (10.764 + 3.817 + 9.213) – (17.664 + 12.064)
∆H reaksi = 23.794 – 29.728
∆H reaksi = -5.934 kJ/mol
Jadi, reaksi C12H26 + 37/2 O2 → 12CO2 + 13H2O ∆H = -5.934 kJ/mol
4. Perhatikan Diagram entalpi di bawah ini
C(s) + O2(g) ∆H3 CO2(g)
∆H1 ∆H2
CO(s) + ½ O2(g)
Berdasarkan hukum hess, pembentukan CO2 dapat melalui beberapa reaksi.
Berapakah nilai perubahan entalpi pembentukan ∆H2, jika diketahui ∆H1 = -110,5
kJ dan ∆H3 = -393,5 kJ.
Keterampilan berpikir kritis: Analisis
Jawab :
∆H3 = ∆H1 + ∆H2
-393,5 kJ = ∆H1 + (-110,5 kJ)
∆H1 = -393,5 kJ + 110,5 kJ
∆H1 = -283 kJ
Jadi, nilai perubahan entalpi pembentukan ∆H2 yakni -283 kJ
51