Page 34 - MODUL KIMIA
P. 34
29. Br 30. Rb 31. Sr 32. Ce & 33. Zr 34. Ni & Mo 35. Ro & Ru
La
Hukum oktaf newlands ternyata hanya berlaku untuk unsur-unsur ringan. Jika diteruskan,
teryata kemiripan sifat terlalu dipaksakan. Misalnya, Ti mempunya sifat yang cukup berbeda dengan
Al maupun B. Kelemahan dari teori ini adalah dalam kenyataanya mesih di ketemukan beberapa oktaf
yang isinya lebih dari delapan unsur. Dan penggolonganya ini tidak cocok untuk unsur yang massa
atomnya sangat besar.
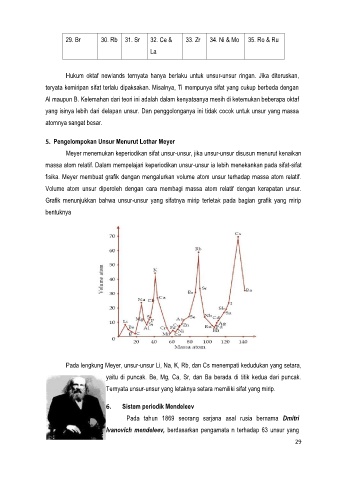
5. Pengelompokan Unsur Menurut Lothar Meyer
Meyer menemukan keperiodikan sifat unsur-unsur, jika unsur-unsur disusun menurut kenaikan
massa atom relatif. Dalam mempelajari keperiodikan unsur-unsur ia lebih menekankan pada sifat-sifat
fisika. Meyer membuat grafik dengan mengalurkan volume atom unsur terhadap massa atom relatif.
Volume atom unsur diperoleh dengan cara membagi massa atom relatif dengan kerapatan unsur.
Grafik menunjukkan bahwa unsur-unsur yang sifatnya mirip terletak pada bagian grafik yang mirip
bentuknya
Pada lengkung Meyer, unsur-unsur Li, Na, K, Rb, dan Cs menempati kedudukan yang setara,
yaitu di puncak. Be, Mg, Ca, Sr, dan Ba berada di titik kedua dari puncak.
Ternyata unsur-unsur yang letaknya setara memiliki sifat yang mirip.
6. Sistem periodik Mendeleev
Pada tahun 1869 seorang sarjana asal rusia bernama Dmitri
Ivanovich mendeleev, berdasarkan pengamata n terhadap 63 unsur yang
29