Page 7 - Modul Elektronik Interaktif Materi Reaksi Redoks
P. 7
2+
3+
Fe (aq) + e → Fe (aq)
Pendalaman Materi
Sebenarnya baik oksidasi maupun reduksi tidak dapat terjadi
sendiri-sendiri seperti contoh di atas, keduanya harus terjadi
bersamaan. Ketika ada ada elektron yang hilang maka ada spesi yang
menangkapnya. Contohnya reaksi yang terjadi antara logam seng
dengan larutan tembaga(II) sulfat berikut.
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Jika mengion reaksinya menjadi:
Zn(s) + Cu (aq) → Zn (aq) + Cu(s)
2+
2+
Reaksi yang bertanda biru itu sebenarnya terdiri dari dua buah
setengah reaksi yaitu
2+
Zn(s) → Zn (aq) + 2e
2+
Cu (aq) + 2e →Cu(s)
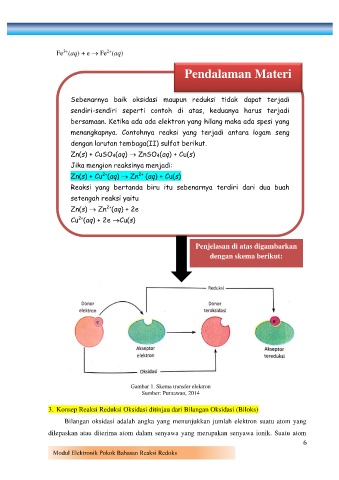
Penjelasan di atas digambarkan
dengan skema berikut:
Gambar 1. Skema transfer elektron
Sumber: Purnawan, 2014
3. Konsep Reaksi Reduksi Oksidasi ditinjau dari Bilangan Oksidasi (Biloks)
Bilangan oksidasi adalah angka yang menunjukkan jumlah elektron suatu atom yang
dilepaskan atau diterima atom dalam senyawa yang merupakan senyawa ionik. Suatu atom
6
Modul Elektronik Pokok Bahasan Reaksi Redoks