Page 47 - E-MODUL SIFAT ASAM BASA SENYAWA ORGANIK_ANDRA MEISANTRY ASSARI_F1062181002_FKIP
P. 47
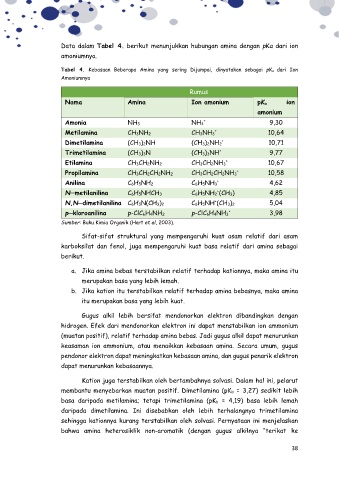
Data dalam Tabel 4. berikut menunjukkan hubungan amina dengan pKa dari ion
amoniumnya.
Tabel 4. Kebasaan Beberapa Amina yang sering Dijumpai, dinyatakan sebagai pK a dari Ion
Amoniumnya
Rumus
Nama Amina Ion amonium pKa ion
amonium
Amonia NH3 NH4 9,30
+
Metilamina CH3NH2 CH3NH3 + 10,64
Dimetilamina (CH3)2NH (CH3)2NH2 + 10,71
Trimetilamina (CH3)3N (CH3)3NH + 9,77
Etilamina CH3CH2NH2 CH3CH2NH3 + 10,67
Propilamina CH3CH2CH2NH2 CH3CH2CH2NH3 + 10,58
Anilina C6H5NH2 C6H5NH3 + 4,62
N─metilanilina C6H5NHCH3 C6H5NH2 (CH3) 4,85
+
+
N,N─dimetilanilina C6H5N(CH3)2 C6H5NH (CH3)2 5,04
p─kloroanilina p-ClC6H4NH2 p-ClC6H4NH3 + 3,98
Sumber: Buku Kimia Organik (Hart et al, 2003).
Sifat-sifat struktural yang mempengaruhi kuat asam relatif dari asam
karboksilat dan fenol, juga mempengaruhi kuat basa relatif dari amina sebagai
berikut.
a. Jika amina bebas terstabilkan relatif terhadap kationnya, maka amina itu
merupakan basa yang lebih lemah.
b. Jika kation itu terstabilkan relatif terhadap amina bebasnya, maka amina
itu merupakan basa yang lebih kuat.
Gugus alkil lebih bersifat mendonorkan elektron dibandingkan dengan
hidrogen. Efek dari mendonorkan elektron ini dapat menstabilkan ion ammonium
(muatan positif), relatif terhadap amina bebas. Jadi gugus alkil dapat menurunkan
keasaman ion ammonium, atau menaikkan kebasaan amina. Secara umum, gugus
pendonor elektron dapat meningkatkan kebasaan amina, dan gugus penarik elektron
dapat menurunkan kebasaannya.
Kation juga terstabilkan oleh bertambahnya solvasi. Dalam hal ini, pelarut
membantu menyebarkan muatan positif. Dimetilamina (pKb = 3,27) sedikit lebih
basa daripada metilamina; tetapi trimetilamina (pKb = 4,19) basa lebih lemah
daripada dimetilamina. Ini disebabkan oleh lebih terhalangnya trimetilamina
sehingga kationnya kurang terstabilkan oleh solvasi. Pernyataan ini menjelaskan
bahwa amina heterosiklik non-aromatik (dengan gugus alkilnya “terikat ke
38