Page 371 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 371
I4. CAP7o7Et?TDFkIÈS
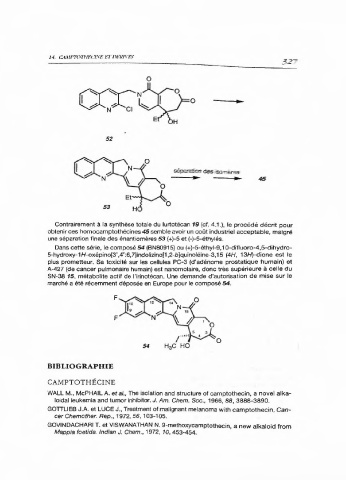
0
+
N- -c1 ~ 0
52
séparation desisareres
l»
Contrairement à la synthèse totale du lurtotécan 19 (cf. 4.1.), le procédé décrit pour
obtenir ces homocamptothécines 45 semble avoir un coût industriel acceptable, malgré
une séparation finale des énantiomères 53 (+)-5 et (-)-5-éthylés.
Dans cette série, le composé 54 (BN80915) ou (+)-5-éthyl-9, 1 0-difluoro-4,5-dihydro-
5-hydroxy-1 H-oxépino(3',4':6,7]indolizino(1,2-b]quinoléine-3,15 (4H, 13/)-dione est le
plus prometteur. Sa toxicité sur les cellules PC-3 (d'adénome prostatique humain) et
A-427 (de cancer pulmonaire humain) est nanomolaire, donc très supérieure à celle du
SN-38 15, métabolite actif de l'irinotécan. Une demande d'autorisation de mise sur le
marché a été récemment déposée en Europe pour le composé 54.
F
F
0
BIBLIOGRAPHIE
CAMPTOTHÉCINE
WALL M., McPHAIL A. et al., The isolation and structure of camptothecin, a novai alka-
loidal leukemia and tumor inhibitor, J. Am. Chem. Soc., 1966, 88, 3888-3890.
GOTTLIEB J.A. et LUCE J., Treatment of malignant melanoma with camptothecin, Can-
cer Chemother. Rep., 1972, 56, 103-105.
GOVINDACHARI T. et VISWANATHAN N. 9-methoxycamptothecin, a new alkaloid from
Mappia foetida. lndian J. Chem., 1972, 10, 453-454.