Page 62 - Chimie organique - cours de Pau 2- Brigitte Jamart
P. 62
Chapitre 2 ■ La géométrie des molécules organiques
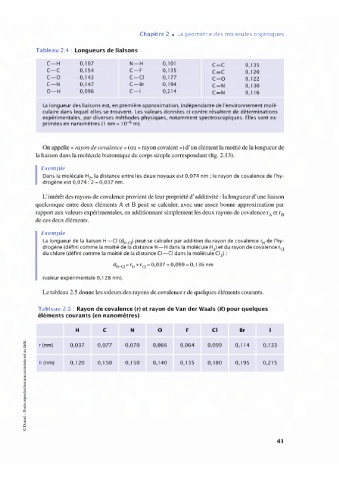
Tableau 2.4: Longueurs de liaisons
CH 0, l 07 N H 0,10 CC 0, 135
CC 0, 154 CF 0, 135 C=C 0, 120
CO 0, 143 C-CI 0, 177 CO 0, 122
CN 0, 147 C Br 0,194 C=N 0, 130
OH 0,096 CI 0,214 C=N 0,116
La longueur des liaisons est, en première approximation, indépendante de l'environnement molé-
culaire dans lequel elles se trouvent. Les valeurs données ci-contre résultent de déterminations
expérimentales, par diverses méthodes physiques, notamment spectroscopiques. Elles sont ex-
9
primées en nanomètres (l nm = 10 m).
On appelle « rayon de covalence » (ou «rayon covalent ») d'un élément la moitié de la longueur de
la liaison dans la molécule biatomique du corps simple correspondant (fig. 2.13).
1 Exemple
Dans la molécule Hz, la distance entre les deux noyaux est 0,074 nm ; le rayon de covalence de l'hy-
drogène est 0,074: 2 = 0,03 7 nm.
L'intérêt des rayons de covalence provient de leur propriété d'additivité: la longueur d'une liaison
quelconque entre deux éléments A et B peut se calculer, avec une assez bonne approximation par
rapport aux valeurs expérimentales, en additionnant simplement les deux rayons de covalence rA et rB
de ces deux éléments.
Exemple
La longueur de la liaison H CI (d,,) peut se calculer par addition du rayon de covalence r,, de l'hy-
drogène (défini comme la moitié de la distance H H dans la molécule Hz) et du rayon de covalence r
du chlore (défini comme la moitié de la distance Cl-Cl dans la molécule Clz):
d,,ca=fa+r=0,037 +0,099 =0,136 nm
(valeur expérimentale 0, l 28 nm).
Le tableau 2.5 donne les valeurs des rayons de covalence r de quelques éléments courants.
Tableau 2.5: Rayon de covalence (r) et rayon de Van der Waals (R) pour quelques
éléments courants (en nanomètres)
H C N 0 F Cl Br
5 r (nm) 0,037 0,077 0,070 0,066 0,064 0,099 0,114 0, 133
"d
:
3
îî
t)
) R(nm) 0, 120 0, 150 0, 150 0,140 0, 135 0, 180 0, 195 0,21 5
-~
z
:
0
:
:
·.g 0
3
"d
0
±
t)
s
g
1
"d
0
:
~ 3
g
41