Page 74 - MODUL REDOKS BERBASIS KEARIN LOKAL
P. 74
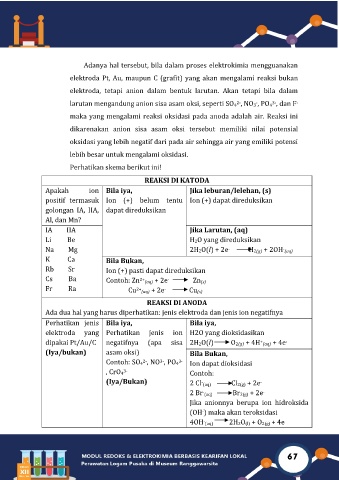
Adanya hal tersebut, bila dalam proses elektrokimia mengguanakan
elektroda Pt, Au, maupun C (grafit) yang akan mengalami reaksi bukan
elektroda, tetapi anion dalam bentuk larutan. Akan tetapi bila dalam
larutan mengandung anion sisa asam oksi, seperti SO4 , NO3 , PO4 , dan F -
3-
-
2-
maka yang mengalami reaksi oksidasi pada anoda adalah air. Reaksi ini
dikarenakan anion sisa asam oksi tersebut memiliki nilai potensial
oksidasi yang lebih negatif dari pada air sehingga air yang emiliki potensi
lebih besar untuk mengalami oksidasi.
Perhatikan skema berikut ini!
REAKSI DI KATODA
Apakah ion Bila iya, Jika leburan/lelehan, (s)
positif termasuk Ion (+) belum tentu Ion (+) dapat direduksikan
golongan IA, IIA, dapat direduksikan
Al, dan Mn?
IA IIA Jika Larutan, (aq)
Li Be H2O yang direduksikan
Na Mg 2H2O(l) + 2e H2(g) + 2OH (aq)
-
-
K Ca Bila Bukan,
Rb Sr Ion (+) pasti dapat direduksikan
Cs Ba Contoh: Zn 2+ (aq) + 2e Zn(s)
-
Fr Ra Cu 2+ (aq) + 2e Cu(s)
-
REAKSI DI ANODA
Ada dua hal yang harus diperhatikan: jenis elektroda dan jenis ion negatifnya
Perhatikan jenis Bila iya, Bila iya,
elektroda yang Perhatikan jenis ion H2O yang dioksidasikan
dipakai Pt/Au/C negatifnya (apa sisa 2H2O(l) O2(g) + 4H (aq) + 4e
+
-
(Iya/bukan) asam oksi) Bila Bukan,
3-
2-
Contoh: SO4 , NO , PO4 3- Ion dapat dioksidasi
, CrO4 Contoh:
3-
(Iya/Bukan) 2 Cl (aq) Cl2(g) + 2e
-
-
2 Br (aq) Br2(g) + 2e -
-
Jika anionnya berupa ion hidroksida
(OH ) maka akan teroksidasi
-
4OH (aq) 2H2O(l) + O2(g) + 4e
-
67