Page 45 - E-MODUL STRUKTUR ATOM DAN SISTEM PERIODIK UNSUR (FITRI)
P. 45
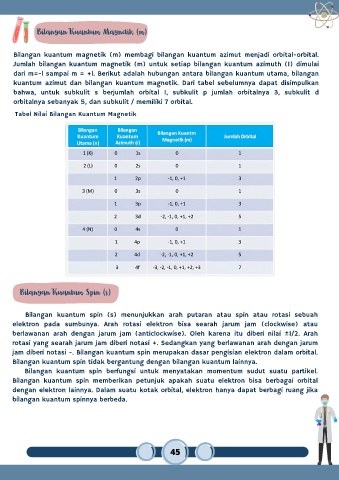
Bilangan Kuantum Magnetik (m)
Bilangan kuantum magnetik (m) membagi bilangan kuantum azimut menjadi orbital-orbital.
Jumlah bilangan kuantum magnetik (m) untuk setiap bilangan kuantum azimuth (1) dimulai
dari m=-l sampai m = +l. Berikut adalah hubungan antara bilangan kuantum utama, bilangan
kuantum azimut dan bilangan kuantum magnetik. Dari tabel sebelumnya dapat disimpulkan
bahwa, untuk subkulit s berjumlah orbital 1, subkulit p jumlah orbitalnya 3, subkulit d
orbitalnya sebanyak 5, dan subkulit / memiliki 7 orbital.
Tabel Nilai Bilangan Kuantum Magnetik
Bilangan Kuantum Spin (s)
Bilangan kuantum spin (s) menunjukkan arah putaran atau spin atau rotasi sebuah
elektron pada sumbunya. Arah rotasi elektron bisa searah jarum jam (clockwise) atau
berlawanan arah dengan jarum jam (anticlockwise). Oleh karena itu diberi nilai ±1/2. Arah
rotasi yang searah jarum jam diberi notasi +. Sedangkan yang berlawanan arah dengan jarum
jam diberi notasi -. Bilangan kuantum spin merupakan dasar pengisian elektron dalam orbital.
Bilangan kuantum spin tidak bergantung dengan bilangan kuantum lainnya.
Bilangan kuantum spin berfungsi untuk menyatakan momentum sudut suatu partikel.
Bilangan kuantum spin memberikan petunjuk apakah suatu elektron bisa berbagai orbital
dengan elektron lainnya. Dalam suatu kotak orbital, elektron hanya dapat berbagi ruang jika
bilangan kuantum spinnya berbeda.
45