Page 12 - Resumen de Química para Pruebas Faro
P. 12
Cuando los átomos no son eléctricamente neutros es porque han ganado o perdido electrones y
reciben el nombre de iones. Si un átomo gana electrones aumenta su carga negativa y se
denominan aniones. Si pierde electrones aumenta la carga positiva y se llaman cationes. Para
representar con símbolos los iones se escribe en la parte superior derecha del símbolo la carga
correspondiente ya sea positiva o negativa.
Por ejemplo si un átomo de azufre gana dos electrones se convierte en un anión al aumentar su
-2
carga negativa por lo tanto, se representará así S . Ahora este átomo tendrá 16 protones, 18
electrones al ganar 2 y 16 neutrones. Para determinar la cantidad de electrones de un anión.
ISÓTOPOS
Son átomos de un mismo elemento que poseen igual número atómico pero diferente número
másico.
Ejemplo: Carbono 12 y Carbono 14, ambas especies poseen 6 como número atómico pero
difieren en la cantidad de neutrones el carbono 12 posee 6 neutrones por eso su número
másico es 12, el carbono 14 posee 8 neutrones por eso su número másico es 14.
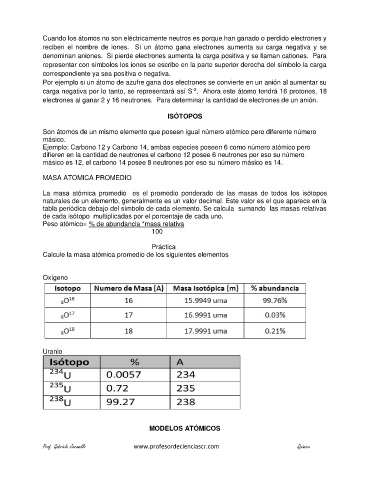
MASA ATOMICA PROMEDIO
La masa atómica promedio es el promedio ponderado de las masas de todos los isótopos
naturales de un elemento, generalmente es un valor decimal. Este valor es el que aparece en la
tabla periódica debajo del símbolo de cada elemento. Se calcula sumando las masas relativas
de cada isótopo multiplicadas por el porcentaje de cada uno.
Peso atómico= % de abundancia *masa relativa
100
Práctica
Calcule la masa atómica promedio de los siguientes elementos
Oxígeno
Uranio
MODELOS ATÓMICOS
Prof. Gabriela Jaramillo www.profesordecienciascr.com Química