Page 35 - Resumen de Química para Pruebas Faro
P. 35
TEORIA DE ENLACE DE VALENCIA (HIBRIDACIÓN DE ORBITALES)
Teoría que explica, las posibilidades de un átomo de incrementar su capacidad para la
formación de enlaces químicos, se relaciona directamente con la geometría molecular.
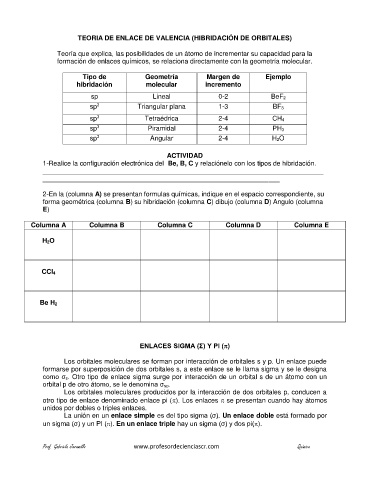
Tipo de Geometría Margen de Ejemplo
hibridación molecular incremento
sp Lineal 0-2 BeF2
sp 2 Triangular plana 1-3 BF3
sp 3 Tetraédrica 2-4 CH4
sp 3 Piramidal 2-4 PH3
sp 3 Angular 2-4 H2O
ACTIVIDAD
1-Realice la configuración electrónica del Be, B, C y relaciónelo con los tipos de hibridación.
____________________________________________________________________________
________________________________________________________________
2-En la (columna A) se presentan formulas químicas, indique en el espacio correspondiente, su
forma geométrica (columna B) su hibridación (columna C) dibujo (columna D) Angulo (columna
E)
Columna A Columna B Columna C Columna D Columna E
H2O
CCl4
Be H2
ENLACES SIGMA (Σ) Y PI ()
Los orbitales moleculares se forman por interacción de orbitales s y p. Un enlace puede
formarse por superposición de dos orbitales s, a este enlace se le llama sigma y se le designa
como σs. Otro tipo de enlace sigma surge por interacción de un orbital s de un átomo con un
orbital p de otro átomo, se le denomina σsp.
Los orbitales moleculares producidos por la interacción de dos orbitales p, conducen a
otro tipo de enlace denominado enlace pi (). Los enlaces se presentan cuando hay átomos
unidos por dobles o triples enlaces.
La unión en un enlace simple es del tipo sigma (σ). Un enlace doble está formado por
un sigma (σ) y un PI (). En un enlace triple hay un sigma (σ) y dos pi().
Prof. Gabriela Jaramillo www.profesordecienciascr.com Química