Page 74 - EMODUL TERMOKIMIA BERBASIS GDL KURMER 2.0
P. 74
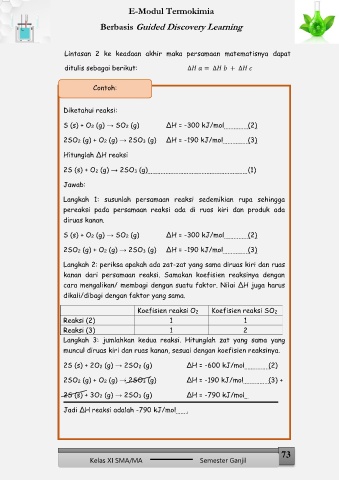
E-Modul Termokimia
Berbasis Guided Discovery Learning
Lintasan 2 ke keadaan akhir maka persamaan matematisnya dapat
ditulis sebagai berikut: ∆ = ∆ + ∆
Contoh:
Diketahui reaksi:
S (s) + O2 (g) → SO2 (g) ∆H = -300 kJ/mol (2)
2SO2 (g) + O2 (g) → 2SO3 (g) ∆H = -190 kJ/mol (3)
Hitunglah ∆H reaksi
2S (s) + O2 (g) → 2SO3 (g) (1)
Jawab:
Langkah 1: susunlah persamaan reaksi sedemikian rupa sehingga
pereaksi pada persamaan reaksi ada di ruas kiri dan produk ada
diruas kanan.
S (s) + O2 (g) → SO2 (g) ∆H = -300 kJ/mol (2)
2SO2 (g) + O2 (g) → 2SO3 (g) ∆H = -190 kJ/mol (3)
Langkah 2: periksa apakah ada zat-zat yang sama diruas kiri dan ruas
kanan dari persamaan reaksi. Samakan koefisien reaksinya dengan
cara mengalikan/ membagi dengan suatu faktor. Nilai ∆H juga harus
dikali/dibagi dengan faktor yang sama.
Koefisien reaksi O2 Koefisien reaksi SO2
Reaksi (2) 1 1
Reaksi (3) 1 2
Langkah 3: jumlahkan kedua reaksi. Hitunglah zat yang sama yang
muncul diruas kiri dan ruas kanan, sesuai dengan koefisien reaksinya.
2S (s) + 2O2 (g) → 2SO2 (g) ∆H = -600 kJ/mol (2)
2SO2 (g) + O2 (g) → 2SO3 (g) ∆H = -190 kJ/mol (3) +
2S (s) + 3O2 (g) → 2SO3 (g) ∆H = -790 kJ/mol
Jadi ∆H reaksi adalah -790 kJ/mol .
73
Kelas XI SMA/MA Semester Ganjil