Page 72 - EMODUL TERMOKIMIA BERBASIS GDL KURMER 2.0
P. 72
E-Modul Termokimia
Berbasis Guided Discovery Learning
Penentuan Perubahan Entalpi (∆H) berdasarkan data
perubahan entalpi pembentukan standar (∆H⸰ f)
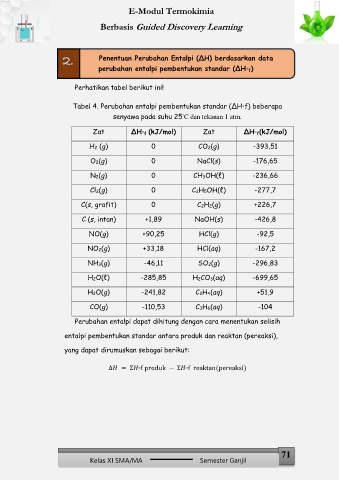
Perhatikan tabel berikut ini!
Tabel 4. Perubahan entalpi pembentukan standar (∆H⸰f) beberapa
⸰
senyawa pada suhu 25 C dan tekanan 1 atm.
Zat ∆H⸰ f (kJ/mol) Zat ∆H⸰ f(kJ/mol)
H2 (g) 0 CO2(g) -393,51
O2(g) 0 NaCl(s) -176,65
N2(g) 0 CH3OH(ℓ) -236,66
Cl2(g) 0 C2H5OH(ℓ) -277,7
C(s, grafit) 0 C2H2(g) +226,7
C (s, intan) +1,89 NaOH(s) -426,8
NO(g) +90,25 HCl(g) -92,5
NO2(g) +33,18 HCl(aq) -167,2
NH3(g) -46,11 SO2(g) -296,83
H2O(ℓ) -285,85 H2CO3(aq) -699,65
H2O(g) -241,82 C2H4(aq) +51,9
CO(g) -110,53 C3H6(aq) -104
Perubahan entalpi dapat dihitung dengan cara menentukan selisih
entalpi pembentukan standar antara produk dan reaktan (pereaksi),
yang dapat dirumuskan sebagai berikut:
∆ = Ʃ ⸰f produk − Ʃ ⸰f reaktan(pereaksi)
71
Kelas XI SMA/MA Semester Ganjil