Page 79 - BAHAN AJAR KAPITA SELEKTA KIMIA BERBASIS CASE METHOD DAN PROJECT
P. 79
5
dikarenakan orbital yang setengah penuh (d ) atau penuh (d ) bersifat lebih stabil
10
dibandingkan dengan orbital yang hampir setengah penuh (d4) atau hampir penuh (d 8
atau d ). Dengan demikian, jika elektron terluar berakhir pada d , d atau d tersebut,
9
9
4
8
maka satu atau semua elektron pada orbital s (yang berada pada tingkat energi yang
lebih rendah dari d) pindah ke orbital subkulit d.
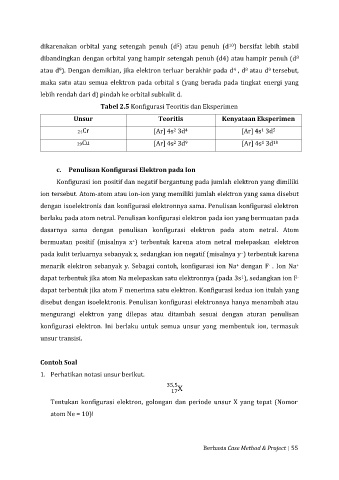
Tabel 2.5 Konfigurasi Teoritis dan Eksperimen
Unsur Teoritis Kenyataan Eksperimen
24Cr [Ar] 4s 3d [Ar] 4s 3d
2
5
1
4
29Cu [Ar] 4s 3d [Ar] 4s 3d 10
2
1
9
c. Penulisan Konfigurasi Elektron pada Ion
Konfigurasi ion positif dan negatif bergantung pada jumlah elektron yang dimiliki
ion tersebut. Atom-atom atau ion-ion yang memiliki jumlah elektron yang sama disebut
dengan isoelektronis dan konfigurasi elektronnya sama. Penulisan konfigurasi elektron
berlaku pada atom netral. Penulisan konfigurasi elektron pada ion yang bermuatan pada
dasarnya sama dengan penulisan konfigurasi elektron pada atom netral. Atom
bermuatan positif (misalnya x ) terbentuk karena atom netral melepaskan elektron
+
pada kulit terluarnya sebanyak x, sedangkan ion negatif (misalnya y ) terbentuk karena
–
menarik elektron sebanyak y. Sebagai contoh, konfigurasi ion Na dengan F . Ion Na +
+
-
dapat terbentuk jika atom Na melepaskan satu elektronnya (pada 3s ), sedangkan ion F -
1
dapat terbentuk jika atom F menerima satu elektron. Konfigurasi kedua ion itulah yang
disebut dengan isoelektronis. Penulisan konfigurasi elektronnya hanya menambah atau
mengurangi elektron yang dilepas atau ditambah sesuai dengan aturan penulisan
konfigurasi elektron. Ini berlaku untuk semua unsur yang membentuk ion, termasuk
unsur transisi.
Contoh Soal
1. Perhatikan notasi unsur berikut.
35,5
17 X
Tentukan konfigurasi elektron, golongan dan periode unsur X yang tepat (Nomor
atom Ne = 10)!
Berbasis Case Method & Project | 55