Page 493 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 493
451
17. MITOXANTR ONE
OH
voie 2
535 1,3
' 3 A= N02 4 R=H
R
HOaS O SOaH ~
NO2
O
2
OH O J [H]
OH
'
NaOH, 0
YN~ aHS0 3/NaOH
s
OH) NH, O NH,
+A OH OH O HH
'< ou Zn / CH3COOH @ H
H
OH O OH OH OH 0
OH OH NR' 7
6 __J
[O] H2N-R'
mitoxantrone
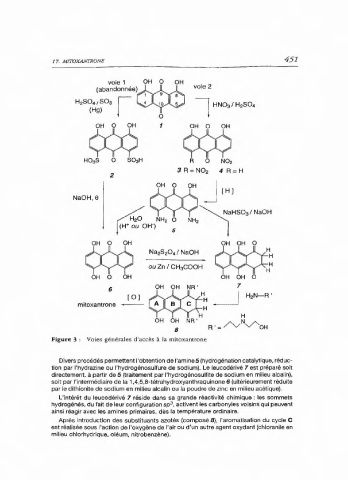
Figure 3 : Voies générales d'accès à la mitoxantrone
Divers procédés permettent l'obtention de l'amine5 (hydrogénation catalytique, réduc-
tion par l'hydrazine ou l'hydrogénosulfure de sodium). Le leucodérivé 7 est préparé soit
directement, à partir de 5 (traitement par l'hydrogénosulfite de sodium en milieu alcalin),
soit par l'intermédiaire de la 1,4,5,8-tétrahydroxyanthraquinone 6 (ultérieurement réduite
par le dithionite de sodium en milieu alcalin ou la poudre de zinc en milieu acétique).
L'intérêt du leucodérivé 7 réside dans sa grande réactivité chimique : les sommets
hydrogénés, du fait de leur configuration sp°, activent les carbonyles voisins qui peuvent
ainsi réagir avec les amines primaires, dès la température ordinaire.
Après introduction des substituants azotés (composé 8), l'aromatisation du cycle C
est réalisée sous l'action de l'oxygène de l'air ou d'un autre agent oxydant (chloranile en
milieu chlorhydrique, oléum, nitrobenzène).