Page 496 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 496
454 MEDICAMENTS INDUISANTOUSTABILISANT DES COUPURES DE l 'ADN
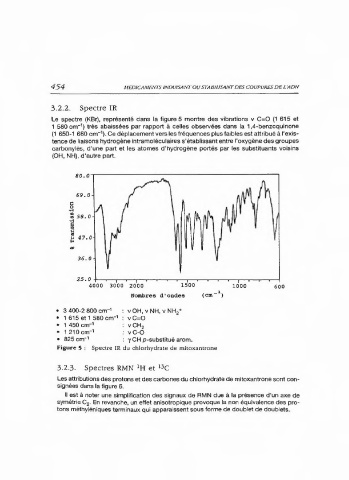
3.2.2. Spectre IR
Le spectre (KBr), représenté dans la figure 5 montre des vibrations v C=O (1 615 et
1 580 cm') très abaissées par rapport à celles observées dans la 1,4-benzoquinone
(1 650-1 660 cm'). Ce déplacement vers les fréquences plus faibles est attribué à l'exis-
tence de liaisons hydrogène intramoléculaires s'établissant entre l'oxygène des groupes
carbonylés, d'une part et les atomes d'hydrogène portés par les substituants voisins
(OH, NH), d'autre part.
80.0
69.0
C
.... 0
.... ss.o
Ili
C .,
g 47.0
36.0
h [] yyyy
4000 3000 2000 1500 1000 600
Nombres d'ondes
• 3 400-2 800 cm- 1 v OH, vNH, v NH,
• 1615et 1 580 cm vC=O
• 1450 cm' vCH,
• 1210cm' vC-0
• 825 cm' y CH p-substitué arom.
Figure 5 : Spectre IR du chlorhydrate de mitoxantrone
3.2.3. Spectres RMN 'H et 13C
Les attributions des protons et des carbones du chlorhydrate de mitoxantrone sont con-
signées dans la figure 6.
Il est à noter une simplification des signaux de RMN due à la présence d'un axe de
symétrie C-,. En revanche, un effet anisotropique provoque la non équivalence des pro-
tons méthyléniques terminaux qui apparaissent sous forme de doublet de doublets.