Page 172 - Traité de Chimie Thérapeutique 2 : Médicaments Antibiotiques
P. 172
162 MÉDICAMENTS ANTIBIOTIQUES
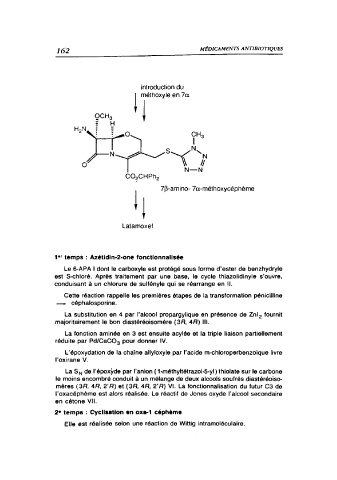
introduction du
! rthoxyle en 7a
OCH,
± H
r
0
7-amino- 7a-méthoxycéphème
Latamoxef
1r temps : Azétidin-2-one fonctionnalisée
Le 6-APA I dont le carboxyle est protégé sous forme d'ester de benzhydryle
est S-chloré. Après traitement par une base, le cycle thiazolidinyle s'ouvre,
conduisant à un chlorure de sulfényle qui se réarrange en Il.
Cette réaction rappelle les premières étapes de la transformation pénicilline
- céphalosporine.
La substitution en 4 par l'alcool propargylique en présence de Znl fournit
majoritairement le bon diastéréoisomère ( 3R, 4R) III.
La fonction aminée en 3 est ensuite acylée et la triple liaison partiellement
réduite par Pd/CaCO, pour donner IV.
L'époxydation de la chaine allyloxyle par l'acide m-chloroperbenzoïque livre
l'oxirane V.
La S, de l'époxyde par l'anion (1-méthyltétrazol-5-yl) thiolate sur le carbone
le moins encombré conduit à un mélange de deux alcools soufrés diastéréoiso-
mères ( 3R, 4R, 2'R) et (3R, 4R, 2'P) VI. La fonctionnalisation du futur C3 de
l'oxacéphème est alors réalisée. Le réactif de Jones oxyde l'alcool secondaire
en cétone VII.
2· temps : Cycllsatlon en oxa-1 céphème
Elle est réalisée selon une réaction de Wittig intramoléculaire.