Page 410 - Traité de Chimie Thérapeutique 2 : Médicaments Antibiotiques
P. 410
400 MÉDICAMENTS ANTIBIOTIQUES
3.6. SYNTHÈSE AU DÉPART DE L'ALCOOL
CINNAMIQUE :
PROCÉDÉ BOEHRINGER-MANNHEIM
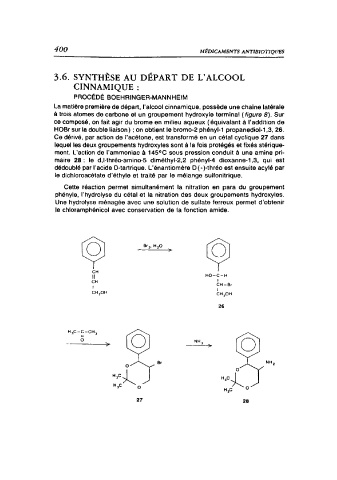
La matière première de départ, l'alcool cinnamique, possède une chaine latérale
à trois atomes de carbone et un groupement hydroxyle terminal ( figure 8). Sur
ce composé, on fait agir du brome en milieu aqueux ( équivalant à l'addition de
HOBr sur la double liaison) ; on obtient le bromo-2 phényl-1 propanediol-1,3, 26.
Ce dérivé, par action de l'acétone, est transformé en un cétal cyclique 27 dans
lequel les deux groupements hydroxyles sont à la fois protégés et fixés stérique-
ment. L'action de l'ammoniac à 145°C sous pression conduit à une amine pri-
maire 28 : le d,/-thréo-amino-5 diméthyl-2,2 phényl-4 dioxanne-1,3, qui est
dédoublé par l'acide D-tartrique. L'énantiomère D (-)-thréo est ensuite acylé par
le dichloroacétate d'éthyle et traité par le mélange sulfonitrique.
Cette réaction permet simultanément la nitration en para du groupement
phényle, l'hydrolyse du cétal et la nitration des deux groupements hydroxyles.
Une hydrolyse ménagée avec une solution de sulfate ferreux permet d'obtenir
le chloramphénicol avec conservation de la fonction amide.
; 0,. H,O 73
CH
Il HO-C-H
CH 1
CH-Br
1
1
CH,OH CH,OH
26
HC--C-CH,
" 0
Br
27 28