Page 165 - Chimie organique - cours de Pau 2- Brigitte Jamart
P. 165
Partie 1 ■ Chimie organique générale
Exemples
"'c=C/ maximum d'absorption vers 180 nm (e= l 0 000)
/ "'
)c=O maximum d'absorption vers 280 nm (€= l 5)
Le reste de la molécule (chaînes saturées) a peu d'influence sur le spectre ultraviolet, et tous les com-
posés possédant un groupe non saturé déterminé ont des spectres très voisins.
€
r
0
a
...
0
UI
o
<C
À(nm)
250 300
Longueur d'onde
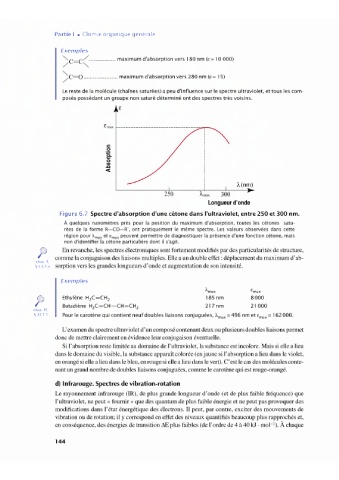
Figure 6.7 Spectre d'absorption d'une cétone dans l'ultraviolet, entre 250 et 300 nm.
À quelques nanomètres près pour la position du maximum d'absorption, toutes les cétones satu-
rées de la forme RCOR', ont pratiquement le même spectre. Les valeurs observées dans cette
région pour "'max et Emax peuvent permettre de diagnostiquer la présence d'une fonction cétone, mais
non d'identifier la cétone particulière dont il s'agit.
2 En revanche, les spectres électroniques sont fortement modifiés par des particularités de structure,
chap. 4, comme la conjugaison des liaisons multiples. Elle a un double effet: déplacement du maximum d'ab-
§ 4.4.1.a sorption vers les grandes longueurs d'onde et augmentation de son intensité.
Exemples
na
p Ethylène H,C=CH, 185 nm 8000
Butadiène H,C=CH CH=CH, 217 nm 21 000
hap. 24,
§ 24.1.1 Pour le carotène qui contient neuf doubles liaisons conjuguées, Àmax = 496 nm et Emax = 162 000.
L'examen du spectre ultraviolet d'un composé contenant deux ou plusieurs doubles liaisons permet
donc de mettre clairement en évidence leur conjugaison éventuelle.
Sil' absorption reste limitée au domaine de l'ultraviolet, la substance est incolore. Mais si elle a lieu
dans le domaine du visible, la substance apparaît colorée (en jaune sil' absorption a lieu dans le violet,
en orangé si elle a lieu dans le bleu, en rouge si elle a lieu dans le vert). C'est le cas des molécules conte-
nant un grand nombre de doubles liaisons conjuguées, comme le carotène qui est rouge-orangé.
d) Infrarouge. Spectres de vibration-rotation
Le rayonnement infrarouge (IR), de plus grande longueur d'onde (et de plus faible fréquence) que
l'ultraviolet, ne peut « fournir » que des quantum de plus faible énergie et ne peut pas provoquer des
modifications dans l'état énergétique des électrons. Il peut, par contre, exciter des mouvements de
vibration ou de rotation; il y correspond en effet des niveaux quantifiés beaucoup plus rapprochés et,
1
en conséquence, des énergies de transition AE plus faibles (de l'ordre de 4 à 40 kJ • mol- ). À chaque
144