Page 220 - EBOOKFISIKA.pdf
P. 220
dan m = 1, yang masing-masing mempunyai dua
kemungkinan nilai s. Jadi, di subkulit p terdapat 6 elektron,
sehingga di kulit L itu terdapat 8 elektron. Pada umumnya,
subkulit p di kulit n = 2, ditulis sebagai 2p, dan seterusnya.
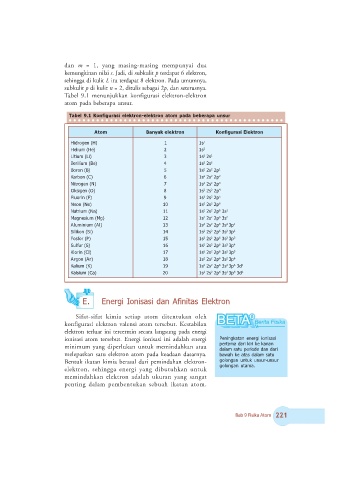
Tabel 9.1 menunjukkan konfigurasi elektron-elektron
atom pada beberapa unsur.
!
"# $% !
"& !
"
' ( ' %" %
○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○ ○
" )
!
"
" $ # % ! *
"
2 5 2 9 + + +
2
5 2 9 ( + (
(
> 9 > 5 ; + ( +
(
5 9 8 + ( (
(
(
9 5 < + ( ( ! +
(
(
: / 5 9 * + ( ( ! (
(
(
5 9 7 + ( ( ! ;
(
(
? 5 ? 9 6 + ( ( ! 8
(
(
9 5 # + ( ( ! <
(
(
5 9 + ) + ( ( ! *
(
*
(
5 9 + + + ( ( ! ; +
(
*
(
5 9 + ( + ( ( ! ; (
*
(
(
(
9 5 + ; + ( ( ! ; ; ! +
(
*
(
(
9
5 + 8 + ( ( ! ; ; ! (
(
(
*
(
9 5 + < + ( ( ! ; ; ! ;
(
*
(
(
9
5 + * + ( ( ! ; ; ! 8
(
(
*
(
: 9 / 5 + 7 + ( ( ! ; ; ! <
*
(
(
(
5 9 + 6 + ( ( ! ; ; ! *
(
*
*
(
(
:
9 : 5 + # + ( ( ! ; ; ! ; +
(
(
*
(
*
:
/ 5 9 ( ) + ( ( ! ; ; ! ; (
%
Sifat-sifat kimia setiap atom ditentukan oleh
konfigurasi elektron valensi atom tersebut. Kestabilan
elektron terluar ini tercermin secara langsung pada energi
ionisasi atom tersebut. Energi ionisasi ini adalah energi
minimum yang diperlukan untuk memindahkan atau !
!
melepaskan satu elektron atom pada keadaan dasarnya. 4
Bentuk ikatan kimia berasal dari pemindahan elektron-
1
%
elektron, sehingga energi yang dibutuhkan untuk
memindahkan elektron adalah ukuran yang sangat
penting dalam pembentukan sebuah ikatan atom.
#