Page 221 - EBOOKFISIKA.pdf
P. 221
Besarnya energi ionisasi merupakan ukuran usaha yang
diperlukan untuk memaksa satu atom untuk melepaskan
elektronnya, atau seberapa erat elektron terikat dalam
atom. Makin besar energi ionisasi, makin sukar untuk
melepaskan elektronnya.
! , "
,
Pada tabel periodik unsur, berbagai macam radiasi atom yang
" %
memiliki atom kecil secara khas memiliki energi ionisasi yang
tinggi, dan atom yang besar memiliki energi ionisasi yang kecil.
Dengan demikian, elemen dengan energi ionisasi terendah
ditemukan di tabel kiri periode yang lebih rendah, dan
energi ionisasi tertinggi ditemukan di tabel sebelah kanan
atas. Variasi dari energi ionisasi berhubungan dengan variasi
radius atom, karena valensi elektron dalam atom yang
besar rata-rata jauh dari inti, maka daya tariknya sangat
lemah. Sebaliknya, valensi elektron dalam atom yang kecil
dekat dengan sumber inti, maka daya tariknya kuat.
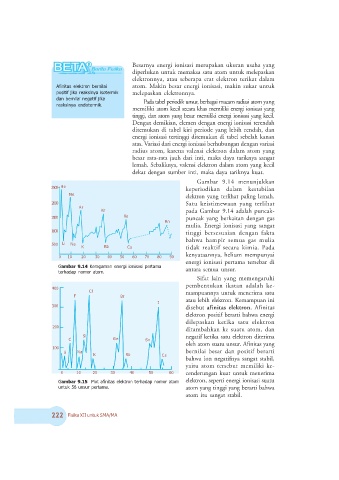
Gambar 9.14 menunjukkan
(<)) 2 keperiodikan dalam kestabilan
elektron yang terlihat paling lemah.
())) Satu keistimewaan yang terlihat
: pada Gambar 9.14 adalah puncak-
+<)) puncak yang berkaitan dengan gas
mulia. Energi ionisasi yang sangat
tinggi bersesuaian dengan fakta
+)))
bahwa hampir semua gas mulia
>
<))
: / tidak reaktif secara kimia. Pada
kenyataannya, helium mempunyai
) +) () ;) 8) <) *) 7) 6) #)
energi ionisasi pertama tersebar di
. : !
antara semua unsur.
! %
Sifat lain yang memengaruhi
pembentukan ikatan adalah ke-
8))
mampuannya untuk menerima satu
/
atau lebih elektron. Kemampuan ini
disebut afinitas elektron. Afinitas
;))
elektron positif berarti bahwa energi
dilepaskan ketika satu elektron
ditambahkan ke suatu atom, dan
())
negatif ketika satu elektron diterima
/ .
oleh atom suatu unsur. Afinitas yang
+)) bernilai besar dan positif berarti
>
: /
bahwa ion negatifnya sangat stabil,
yaitu atom tersebut memiliki ke-
cenderungan kuat untuk menerima
) +) () ;) 8) <) *)
elektron, seperti energi ionisasi suatu
. !
atom yang tinggi yang berarti bahwa
<*
! %
atom itu sangat stabil.