Page 126 - 07 Schrödinger
P. 126
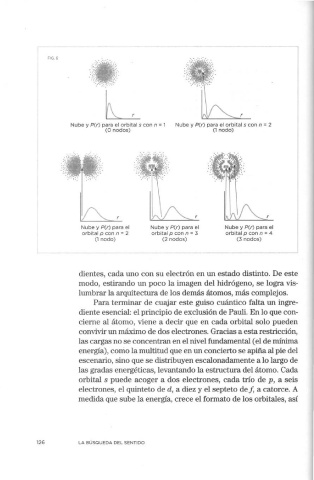
FIG. 6
Nube y P(r) para el orbital s con n = 1 Nube y P(r) para el orbital s con n = 2
(O nodos) (1 nodo)
r
Nube y P(r) para el Nube y P(r) para el Nube y P(r) para el
orbital p con n = 2 orbital p con n = 3 orbital p con n = 4
(1 nodo) (2 nodos) (3 nodos)
dientes, cada uno con su electrón en un estado distinto. De este
modo, estirando un poco la imagen del hidrógeno, se logra vis-
lumbrar la arquitectura de los demás átomos, más complejos.
Para terminar de cuajar este guiso cuántico falta un ingre-
diente esencial: el principio de exclusión de Pauli. En lo que con-
cierne al átomo, viene a decir que en cada orbital solo pueden
convivir un máximo de dos electrones. Gracias a esta restricción,
las cargas no se concentran en el nivel fundamental ( el de rrúnirna
energía), corno la multitud que en un concierto se apiña al pie del
escenalio, sino que se distribuyen escalonadarnente a lo largo de
las gradas energéticas, levantando la estructura del átomo. Cada
orbital s puede acoger a dos electrones, cada trío de p, a seis
electrones, el quinteto de d, a diez y el septeto def, a catorce. A
medida que sube la energía, crece el formato de los orbitales, así
126 LA BÚSQUEDA DEL SENTIDO