Page 13 - quimica
P. 13
Química 5° San Marcos
oy =1, es decir, reacción es de primer orden en H2. Por tanto, la ley de rapidez esta dada por
2
rapidez = k NO H
2
Lo que muestra que es una reacción de tipo (2+1) o de tercer global.
b. La constante de rapidez k se calcula utilziando los valores de caulquiera de los experimentos. Recordando la ley
de rapidez, obtenemos.
rapidez
k =
2
NO H 2
Los datos del experimento 2 dan como resultado
5
5.0 10 M/s
K = 2
( 10.0 10 − 3 ) ( 2.0 10 M − 3 )
2.5 10 /M s= 2 2
c. Utilizando la constante de rapidez conocida y las concentraciones de NO y H2, escribimos
2
rapidez = (2.5 10 /M s 12.0 10 M 2 2 )( − 3 ) ( 6.0 10 M − 3 )
22 10 M/s= − 4
Comentario Observe que la reacción es de primer orden en relación con H2, a pesar de que el coeficiente
estequiométrico de H2 en la ecuación balanceada es 2. El orden de un reactivo no está relacionado con el
coeficiente estequiométrico del reactivo en la ecuación global balanceada.
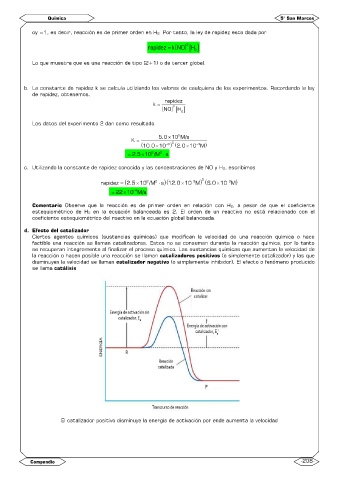
d. Efecto del catalizador
Ciertos agentes químicos (sustancias químicas) que modifican la velocidad de una reacción química o hace
factible una reacción se llaman catalizadores. Estos no se consumen durante la reacción química, por lo tanto
se recuperan íntegramente al finalizar el proceso químico. Las sustancias químicas que aumentan la velocidad de
la reacción o hacen posible una reacción se llaman catalizadores positivos (o simplemente catalizador) y las que
disminuyen la velocidad se llaman catalizador negativo (o simplemente inhibidor). El efecto o fenómeno producido
se llama catálisis
El catalizador positivo disminuye la energía de activación por ende aumenta la velocidad
Compendio -208-