Page 43 - REAKSI SEnyawa organik MONOFUNGSI
P. 43
Chapter 3 Alkil halida
dengan gaya dispersi sementara. Namun, hanya ada gaya dispersi London
yang beroperasi pada hidrokarbon induknya. Oleh karena itu, titik didih
dan titik leleh senyawa-senyawa ini lebih besar dibandingkan hidrokarbon
dengan berat molekul sebanding.
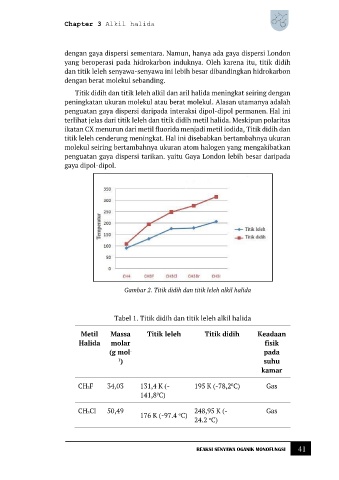
Titik didih dan titik leleh alkil dan aril halida meningkat seiring dengan
peningkatan ukuran molekul atau berat molekul. Alasan utamanya adalah
penguatan gaya dispersi daripada interaksi dipol-dipol permanen. Hal ini
terlihat jelas dari titik leleh dan titik didih metil halida. Meskipun polaritas
ikatan CX menurun dari metil fluorida menjadi metil iodida, Titik didih dan
titik leleh cenderung meningkat. Hal ini disebabkan bertambahnya ukuran
molekul seiring bertambahnya ukuran atom halogen yang mengakibatkan
penguatan gaya dispersi tarikan. yaitu Gaya London lebih besar daripada
gaya dipol-dipol.
Gambar 2. Titik didih dan titik leleh alkil halida
Tabel 1. Titik didih dan titik leleh alkil halida
Metil Massa Titik leleh Titik didih Keadaan
Halida molar fisik
(g mol - pada
1 ) suhu
kamar
CH3F 34,03 131,4 K (- 195 K (-78,2 C) Gas
0
141,8 C)
0
CH3Cl 50,49 248,95 K (- Gas
176 K (-97.4 C)
o
24.2 C)
o
REAKSI SENYAWA OGANIK MONOFUNGSI 41