Page 45 - E-Modul Asam Basa
P. 45
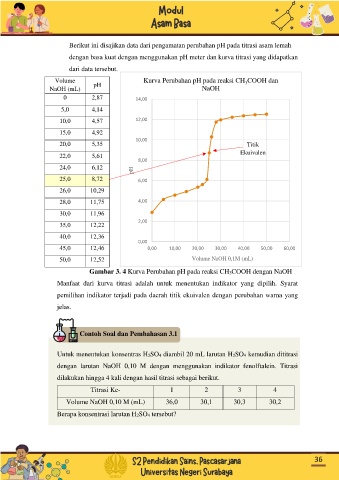
Berikut ini disajikan data dari pengamatan perubahan pH pada titrasi asam lemah
dengan basa kuat dengan menggunakan pH meter dan kurva titrasi yang didapatkan
dari data tersebut.
Volume Kurva Perubahan pH pada reaksi CH COOH dan
3
NaOH (mL) pH NaOH
0 2,87 14,00
5,0 4,14
10,0 4,57 12,00
15,0 4,92
10,00
20,0 5,35 Titik
Ekuivalen
22,0 5,61
8,00
24,0 6,12
pH
25,0 8,72 6,00
26,0 10,29
28,0 11,75 4,00
30,0 11,96
2,00
35,0 12,22
40,0 12,36
0,00
45,0 12,46 0,00 10,00 20,00 30,00 40,00 50,00 60,00
50,0 12,52 Volume NaOH 0,1M (mL)
Gambar 3. 4 Kurva Perubahan pH pada reaksi CH3COOH dengan NaOH
Manfaat dari kurva titrasi adalah untuk menentukan indikator yang dipilih. Syarat
pemilihan indikator terjadi pada daerah titik ekuivalen dengan perubahan warna yang
jelas.
Contoh Soal dan Pembahasan 3.1
Untuk menentukan konsentras H2SO4 diambil 20 mL larutan H2SO4 kemudian dititrasi
dengan larutan NaOH 0,10 M dengan menggunakan indikator fenolftalein. Titrasi
dilakukan hingga 4 kali dengan hasil titrasi sebagai berikut.
Titrasi Ke- 1 2 3 4
Volume NaOH 0,10 M (mL) 36,0 30,1 30,3 30,2
Berapa konsentrasi larutan H2SO4 tersebut?
36