Page 42 - E-Modul Asam Basa
P. 42
−
−2
[ ] = 0,011 = 2,9 10
= − [ ]
−
−2
= − log 2,9 10
= 2 − log 2,9
= 14 − (2 − 2)
= 12 + 2
= 12,46
Dengan cara tersebut, maka akan diperoleh data seperti pada tabel berikut. Selanjutnya,
dari data itu dapat dibuat kurva titrasi asam kuat dengan basa kuat.
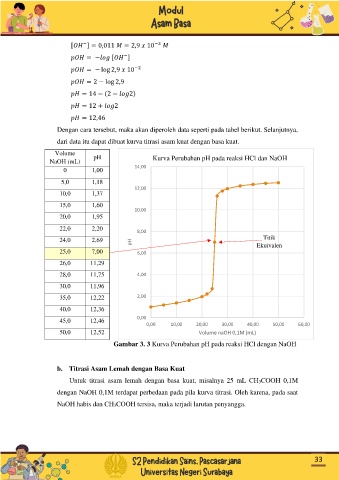
Volume pH
NaOH (mL) Kurva Perubahan pH pada reaksi HCl dan NaOH
14,00
0 1,00
5,0 1,18
12,00
10,0 1,37
15,0 1,60
10,00
20,0 1,95
22,0 2,20
8,00
24,0 2,69 Titik
pH Ekuivalen
25,0 7,00 6,00
26,0 11,29
28,0 11,75 4,00
30,0 11,96
35,0 12,22 2,00
40,0 12,36
45,0 12,46 0,00
0,00 10,00 20,00 30,00 40,00 50,00 60,00
50,0 12,52 Volume naOH 0,1M (mL)
Gambar 3. 3 Kurva Perubahan pH pada reaksi HCl dengan NaOH
b. Titrasi Asam Lemah dengan Basa Kuat
Untuk titrasi asam lemah dengan basa kuat, misalnya 25 mL CH3COOH 0,1M
dengan NaOH 0,1M terdapat perbedaan pada pila kurva titrasi. Oleh karena, pada saat
NaOH habis dan CH3COOH tersisa, maka terjadi larutan penyangga.
33