Page 678 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 678
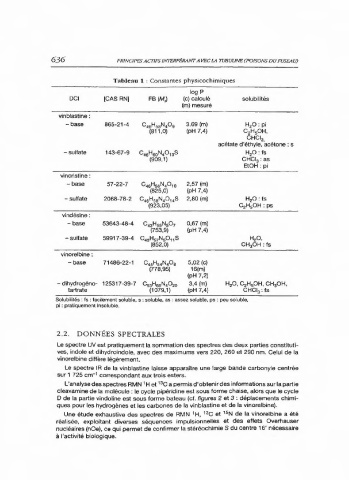
636 PRINCIPES ACTIFS INTERFERANTAVECLA TUBULINE POISONS DUFUSEAU)
Tableau 1 : Constantes physicochimiques
log P
DCI [CAS RN] FB (M,) (c) calculé solubilités
(m) mesuré
vinblastine :
- base 865-21-4 3,69(m) H,O:pi
(pH 7,4) C,H,OH,
CHCl
3
acétate d'éthyle, 'acétone : s
- sulfate 143-67-9 H,O:fs
CHCl, : as
EtOH:pi
vincristine :
- base 57-22-7 COaH,On 2,57(m)
(825,0) (pH 7,4)
- sulfate 2068-78-2 CaHN,0,,S 2,80(m) H,O:fs
(923,05) C,H,OH: ps
vindésine:
- base 53643-48-4 CO,aH,NO, 0,67(m)
(753,9) (pH 7,4)
- sulfate 59917-39-4 CH,4N0,,s H,O.
(852,0) CH,OH: ts
vinorelbine :
- base 71486-22-1 Os!s,MO 5,02 (c)
(778,95) 16(m)
(pH 7,2)
- dihydrogéno- 125317-39-7 Cor4O 3,4(m) H,O, C,H,OH, CH,OH,
tartrate (1079,1) (pH 7,4) CHI, : fs
Solubilités : fs : facilement soluble, s : soluble, as : assez soluble, ps : peu soluble,
pi : pratiquement insoluble.
2.2. DONNÉES SPECTRALES
Le spectre UV est pratiquement la sommation des spectres des deux parties constituti-
ves, indole et dihydroindole, avec des maximums vers 220, 260 et 290 nm. Celui de la
vinorelbine diffère légèrement.
Le spectre IR de la vinblastine laisse apparaître une large bande carbonyle centrée
sur 1 725 cm' correspondant aux trois esters.
13
l'analyse des spectres RMN 1 H et c a permis d'obtenir des informations sur la partie
cleavamine de la molécule : le cycle pipéridine est sous forme chaise, alors que le cycle
D de la partie vindoline est sous forme bateau (cf. figures 2 et 3 : déplacements chimi-
ques pour les hydrogènes et les carbones de la vinblastine et de la vinorelbine).
1
Une étude exhaustive des spectres de RMN 'H, "·C et SN de la vinorelbine a été
réalisée, exploitant diverses séquences Impulsionnelles et des effets Overhauser
nucléaires (nOe), ce qui permet de confirmer la stéréochimie S du centre 16' nécessaire
à l'activité biologique.