Page 279 - Traité de Chimie Thérapeutique 2 : Médicaments Antibiotiques
P. 279
7. LA FOSFOMYCINE 269
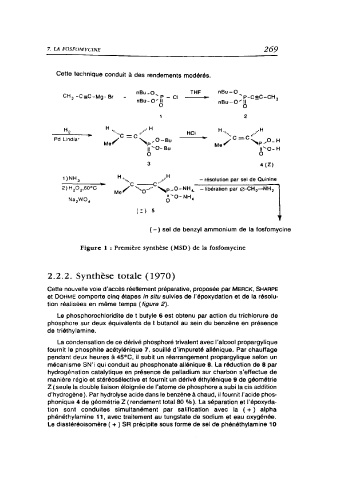
Cette technique conduit à des rendements modérés.
CH, -CsC-Mg- Br nBu-0..._ p _ Cl THF nBu --0 p-c=C-CH
nBu- 0"11 o nBu--0Il - 3
0
2
H ·•·····c = C ••.··•· H HCI H ·•.••., C =."
Pd Lindlar Mt ,-O-u ,O-H
11 '0- Bu ItO -H
0 0
3 4(Z)
H. A - résolution par set de Quinine
Mur ·c--c··
2)H,0,60°c pO-NH, -libération par -CH,-NH,
O-NH
Na,0, 0 4
(z) 5
(-) sel de benzyl ammonium de la fosfomycine
Figure 1 : Première synthèse ( MSD) de la fosfomycine
2.2.2. Synthèse totale (1970)
Cette nouvelle voie d'accès réellement préparative, proposée par MERCK, SHARPE
et D0HME comporte cinq étapes in situ suivies de l'époxydation et de la résolu-
tion réalisées en même temps ( figure 2).
Le phosphorochloridite de t butyle 6 est obtenu par action du trichlorure de
phosphore sur deux équivalents de t butanol au sein du benzène en présence
de triéthylamine.
La condensation de ce dérivé phosphoré trivalent avec l'alcool propargylique
fournit le phosphite acétylénique 7, souillé d'impureté allénique. Par chauffage
pendant deux heures à 45°C, il subit un réarrangement propargylique selon un
mécanisme SN'i qui conduit au phosphonate allénique 8. La réduction de 8 par
hydrogénation catalytique en présence de palladium sur charbon s'effectue de
manière régio et stéréosélective et fournit un dérivé éthylénique 9 de géométrie
Z ( seule la double liaison éloignée de l'atome de phosphore a subi lacis addition
d'hydrogène). Par hydrolyse acide dans le benzène à chaud, il fournit l'acide phos-
phonique 4 de géométrie Z ( rendement total 80 0/o ). La séparation et l'époxyda-
tion sont conduites simultanément par salification avec la ( + ) alpha
phénéthylamine 11, avec traitement au tungstate de sodium et eau oxygénée.
Le diastéréoisomère ( + ) SR précipite sous forme de sel de phénéthylamine 10