Page 467 - Traité de Chimie Thérapeutique 2 : Médicaments Antibiotiques
P. 467
12. QUINOLONES 457
3-L'anilinométhylànemalonate de diéthyle 3 peut également être obtenu à partir
de 1 et du mélange: formimidate d'éthyle 9 et malonate de diéthyle 10. (schéma
3b)
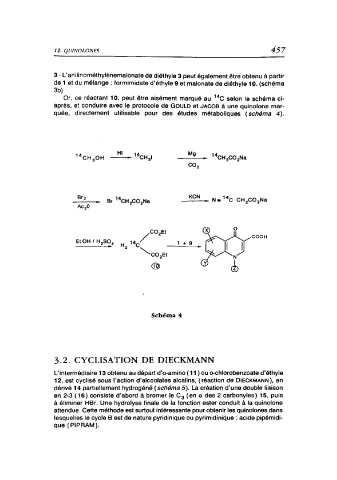
Or, ce réactant 10, peut être aisément marqué au 14 C selon le schéma ci-
après, et conduire avec le protocole de GouLD et JACOB à une quinolone mar-
que, directement utilisable pour des études métaboliques ( schéma 4).
'c1,oH Hl 1%c,1 Mg tcH,co,Na
COOH
1 4 9
Schéma 4
3.2. CYCLISATION DE DIECKMANN
L'intermédiaire 13 obtenu au départ d'o-amino (11) ou o-chlorobenzoate d'éthyle
12, est cyclisé sous l'action d'alcoolates alcalins, ( réaction de DIECKMANN), en
dérivé 14 partiellement hydrogéné ( schéma 5). La création d'une double liaison
en 2-3 (16) consiste d'abord à bramer le C (en a des 2 carbonyles) 15, puis
3
à éliminer HBr. Une hydrolyse finale de la fonction ester conduit à la quinolone
attendue. Cette méthode est surtout intéressante pour obtenir les quinolones dans
lesquelles le cycle B est de nature pyridinique ou pyrimidinique : acide pip6midi-
que (PIPRAM).