Page 177 - Chimie organique - cours de Pau 2- Brigitte Jamart
P. 177
Partie 1 ■ Chimie organique générale
6.6.3 Spectrométrie de masse
fJ La spectrométrie de masse est une technique entièrement différente des précédentes, puisqu'il ne
web s'agit plus d'une absorption du rayonnement par la matière.
L'échantillon est introduit dans une enceinte où règne le vide, vaporisé, puis soumis à un
bombardement parun faisceau d'électrons de grande énergie. Cebombardement provoque l'ionisation
des molécules, par arrachement d'un électron, et on obtient ainsi une espèce qui est à la fois un cation
(par sa charge positive) et un radical libre (par la possession d'un électron impair), quel' on appelle ion
moléculaire ou ion-parent. Celui-ci peut ensuite se fragmenter par la rupture de certaines liaisons,
pour donner d'autres ions positifs de masse plus faible. Ces derniers peuvent à leur tour se fragmenter
encore et on obtient donc en définitive un grand nombre (parfois plusieurs dizaines) d'ions différents ;
ils sont d'autant plus nombreux que la molécule est plus «grosse» et comporte davantage d'atomes.
Ces divers ions sont ensuite accélérés dans un champ électrique puis dirigés, sous la forme d'un
faisceau, entre les pôles d'un aimant. Sous l'effet du champ magnétique, leur trajectoire s'incurve
pour devenir circulaire, avec un rayon de courbure qui dépend du rapport mlz de leur masse à leur
charge. Cette trajectoire les conduit sur un récepteur, qui détecte leur arrivée et fournit un signal élec-
trique. En faisant varier le champ électrique, donc la vitesse des ions, on peut faire en sorte qu'ils
parviennent successivement au récepteur, dans l'ordre croissant de leur rapport mlz, c'est-à-dire en
fait dans l'ordre croissant de leur masse m, car leur chargez est pratiquement toujours égale à l'unité.
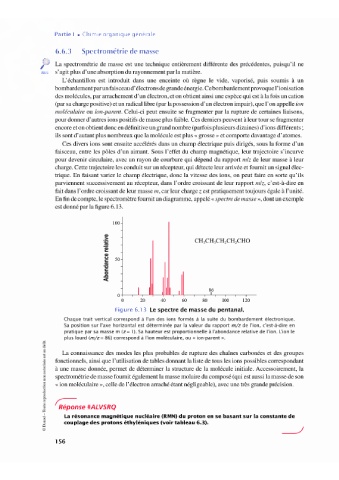
En fin de compte, le spectromètre fournit un diagramme, appelé « spectre de masse», dont un exemple
est donné par la figure 6.13.
100
Q)
>
:;::::;
Cl!
...
a
Q)
so
Cl!
o
r
0
o
<r
1
«l 1 1 1 1111 IL
0 20 40 60 80 100 120
Figure 6.13 Le spectre de masse du pentanal.
Chaque trait vertical correspond à l'un des ions formés à la suite du bombardement électronique.
Sa position sur l'axe horizontal est déterminée par la valeur du rapport m/z de l'ion, c'est-à-dire en
pratique par sa masse m (z = l ). Sa hauteur est proportionnelle à l'abondance relative de l'ion. L'ion le
plus lourd (m/z = 86) correspond à l'ion moléculaire, ou «ion-parent».
La connaissance des modes les plus probables de rupture des chaînes carbonées et des groupes
fonctionnels, ainsi que l'utilisation de tables donnant la liste de tous les ions possibles correspondant
à une masse donnée, permet de déterminer la structure de la molécule initiale. Accessoirement, la
spectrométrie de masse fournit également la masse molaire du composé (qui est aussi la masse de son
« ion moléculaire », celle del' électron arraché étant négligeable), avec une très grande précision.
'Réponse #ALVSRQ
La résonance magnétique nucléaire (RMN) du proton en se basant sur la constante de
couplage des protons éthyléniques (voir tableau 6.3).
156