Page 15 - Salinan dari Salinan dari E-Modul Asam Basa (220 x 297 mm) (220 x 307 mm)
P. 15
Definisi bronsted-Lowry juga berlaku baik untuk basa (seperti NH₃)
yang tidak mengandung ion OH⁻ tetapi menghasilkan ion OH⁻
dalam larutan. Berdasarkan persamaan ini, produk dari Bronsted-
Lowry BH⁺ dan A⁻, spesi A⁻ yang dihasilkan ketika HA kehilangan
proton dapat menerima kembali proton dari BH⁺, yang berarti bahwa
itu adalah basa Bronsted-Lowry. Spesi kimia yang rumusnya hanya
berbeda satu proton disebut sebagai pasangan asam konjugat. Jadi
A⁻ adalah basa konjugasi dari asam HA dan HA adalah asam
konjugasi dari A⁻
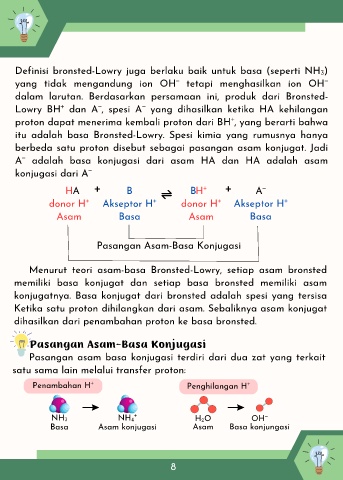
HA + B B H⁺ + A⁻
donor H⁺ Akseptor H⁺ donor H⁺ Akseptor H⁺
Asam Basa Asam Basa
Pasangan Asam-Basa Konjugasi
Menurut teori asam-basa Bronsted-Lowry, setiap asam bronsted
memiliki basa konjugat dan setiap basa bronsted memiliki asam
konjugatnya. Basa konjugat dari bronsted adalah spesi yang tersisa
Ketika satu proton dihilangkan dari asam. Sebaliknya asam konjugat
dihasilkan dari penambahan proton ke basa bronsted.
Pasangan Asam-Basa Konjugasi
Pasangan asam basa konjugasi terdiri dari dua zat yang terkait
satu sama lain melalui transfer proton:
Penambahan H⁺ Penghilangan H⁺
NH₃ NH₄⁺ H₂O OH⁻
Basa Asam konjugasi Asam Basa konjungasi
8