Page 52 - E-MODUL PEMBELAJARAN TERMOKIMIA BERBASIS PBL
P. 52
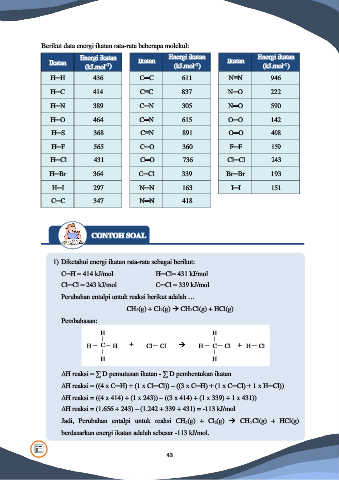
Berikut data energi ikatan rata-rata beberapa molekul:
Energi ikatan Energi ikatan Energi ikatan
Ikatan Ikatan Ikatan
-1
-1
-1
(kJ.mol ) (kJ.mol ) (kJ.mol )
H─H 436 C═C 611 N≡N 946
H─C 414 C≡C 837 N─O 222
H─N 389 C─N 305 N═O 590
H─O 464 C═N 615 O─O 142
H─S 368 C≡N 891 O═O 498
H─F 565 C─O 360 F─F 159
H─Cl 431 C═O 736 Cl─Cl 243
H─Br 364 C─Cl 339 Br─Br 193
H─I 297 N─N 163 I─I 151
C─C 347 N═N 418
CONTOH SOAL
1) Diketahui energi ikatan rata-rata sebagai berikut:
C─H = 414 kJ/mol H─Cl= 431 kJ/mol
Cl─Cl = 243 kJ/mol C─Cl = 339 kJ/mol
Perubahan entalpi untuk reaksi berikut adalah …
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
Pembahasan:
H H
H C H + Cl Cl → H C Cl + H Cl
H H
∆H reaksi = ∑ D pemutusan ikatan - ∑ D pembentukan ikatan
∆H reaksi = ((4 x C─H) + (1 x Cl─Cl)) – ((3 x C─H) + (1 x C─Cl) + 1 x H─Cl))
∆H reaksi = ((4 x 414) + (1 x 243)) – ((3 x 414) + (1 x 339) + 1 x 431))
∆H reaksi = (1.656 + 243) – (1.242 + 339 + 431) = -113 kJ/mol
Jadi, Perubahan entalpi untuk reaksi CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
berdasarkan energi ikatan adalah sebesar -113 kJ/mol.
43