Page 51 - E-MODUL PEMBELAJARAN TERMOKIMIA BERBASIS PBL
P. 51
o
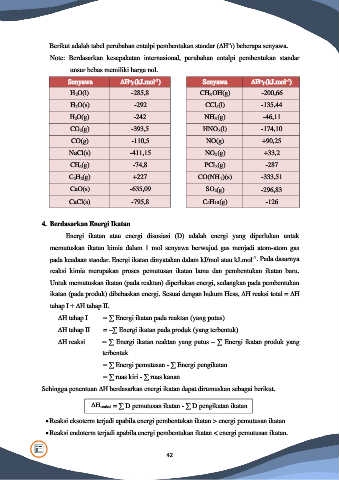
Berikut adalah tabel perubahan entalpi pembentukan standar (∆H f) beberapa senyawa.
Note: Berdasarkan kesepakatan internasional, perubahan entalpi pembentukan standar
unsur bebas memiliki harga nol.
-1
Senyawa ∆H f (kJ.mol ) Senyawa ∆H f (kJ.mol )
-1
o
o
H2O(l) -285,8 CH3OH(g) -200,66
H2O(s) -292 CCl4(l) -135,44
H2O(g) -242 NH3(g) -46,11
CO2(g) -393,5 HNO3(l) -174,10
CO(g) -110,5 NO(g) +90,25
NaCl(s) -411,15 NO2(g) +33,2
CH4(g) -74,8 PCl3(g) -287
C2H2(g) +227 CO(NH2)(s) -333,51
CaO(s) -635,09 SO2(g) -296,83
CaCl(s) -795,8 C4H10(g) -126
4. Berdasarkan Energi Ikatan
Energi ikatan atau energi disosiasi (D) adalah energi yang diperlukan untuk
memutuskan ikatan kimia dalam 1 mol senyawa berwujud gas menjadi atom-atom gas
pada keadaan standar. Energi ikatan dinyatakan dalam kJ/mol atau kJ.mol . Pada dasarnya
-1
reaksi kimia merupakan proses pemutusan ikatan lama dan pembentukan ikatan baru.
Untuk memutuskan ikatan (pada reaktan) diperlukan energi, sedangkan pada pembentukan
ikatan (pada produk) dibebaskan energi. Sesuai dengan hukum Hess, ∆H reaksi total = ∆H
tahap I + ∆H tahap II.
∆H tahap I = ∑ Energi ikatan pada reaktan (yang putus)
∆H tahap II = –∑ Energi ikatan pada produk (yang terbentuk)
∆H reaksi = ∑ Energi ikatan reaktan yang putus – ∑ Energi ikatan produk yang
terbentuk
= ∑ Energi pemutusan - ∑ Energi pengikatan
= ∑ ruas kiri - ∑ ruas kanan
Sehingga penentuan ∆H berdasarkan energi ikatan dapat dirumuskan sebagai berikut.
ΔHreaksi = ∑ D pemutusan ikatan - ∑ D pengikatan ikatan
• Reaksi eksoterm terjadi apabila energi pembentukan ikatan > energi pemutusan ikatan
• Reaksi endoterm terjadi apabila energi pembentukan ikatan < energi pemutusan ikatan.
42