Page 265 - Traité de Chimie Thérapeutique Vol1 Dénomination chimique
P. 265
242 DÊNOMINA DON CHIMIQUE
Stéréochimie : il faut partir du 5a-cholane qui est 20R.
• En série stéroïde 20R signifie une position dans l'espace des sommets autour de 20
(17, 21,22 et H).
• Cette position change ici, 21 passe au dessus du plan et H au dessous ; pourtant le
produit final est encore 20R, à cause des changements de priorité dus à la cyclisation.
• Il faut absolument indiquer le changement d'orientation du sommet 21, et on ne
peut le faire qu'en indiquant (20R).
Cyclo : la cyclisation peut être effectuée entre des sommets extracycliques.
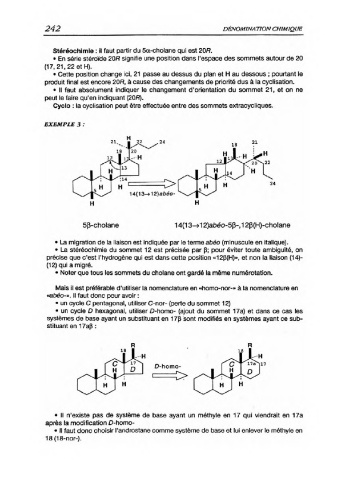
EXEMPLE 3 :
14(13-» 12) abéo-
5|ï-cholane 14(13->12)abéo-53-,12f)(H)-cholane
• La migration de la liaison est indiquée par le terme abéo (minuscule en italique).
• La stéréochimie du sommet 12 est précisée par P; pour éviter toute ambiguïté, on
précise que c’est l’hydrogène qui est dans cette position «12P(H)», et non la liaison (14)-
(12) qui a migré.
• Noter que tous les sommets du cholane ont gardé la même numérotation.
Mais il est préférable d’utiliser la nomenclature en «homo-nor— à la nomenclature en
«abéo-». Il faut donc pour avoir :
• un cycle C pentagonal, utiliser C-nor- (perte du sommet 12)
• un cycle D hexagonal, utiliser D-homo- (ajout du sommet 17a) et dans ce cas les
systèmes de base ayant un substituant en 17P sont modifiés en systèmes ayant ce sub
stituant en 17ap :
D-homo-
• Il n’existe pas de système de base ayant un méthyle en 17 qui viendrait en 17a
après la modification D-homo-
• Il faut donc choisir l’androstane comme système de base et lui enlever le méthyle en
18 (18-nor-J.