Page 695 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 695
31. PACLITAXEL ETDOCETAXEL 653
0
3a R H
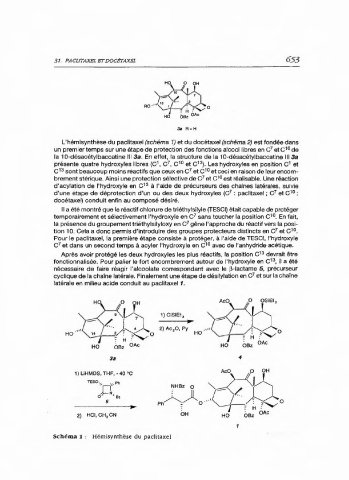
L'hémisynthèse du paclitaxel (schéma 1) et du docétaxel (schéma 2) est fondée dans
1
un premier temps sur une étape de protection des fonctions alcool libres en C et c 10 de
la 10-désacétylbaccatine Ill 3a. En effet, la structure de la 10-désacétylbaccatine 1113a
3
présente quatre hydroxyles libres (C',07,c0 10 et C' ). Les hydroxyles en position C' et
1
C 13 sont beaucoup moins réactifs que ceux en C et c 10 et ceci en raison de leur encom-
1
brement stérique. Ainsi une protection sélective de C et C 10 est réalisable. Une réaction
d'acylation de l'hydroxyle en C 13 à l'aide de précurseurs des chaînes latérales, suivie
7
d'une étape de déprotection d'un ou des deux hydroxyles (C : paclitaxel ; C et c 10 :
7
docétaxel) conduit enfin au composé désiré.
Il a été montré que le réactif chlorure de triéthylsilyle (TESCI) était capable de protéger
temporairement et sélectivement l'hydroxyle en C' sans toucher la position C 10 • En fait,
la présence du groupement triéthylsilyloxy en C'gêne l'approche du réactif vers la posi-
tion 10. Cela a donc permis d'introduire des groupes protecteurs distincts en C' et c 10 .
Pour le paclitaxel, la première étape consiste à protéger, à l'aide de TESCI, l'hydroxyle
C et dans un second temps à acyler l'hydroxyle en C'avec de l'anhydride acétique.
Après avoir protégé les deux hydroxyles les plus réactifs, la position C 13 devrait être
13
fonctionnalisée. Pour palier le fort encombrement autour de l'hydroxyle en C , il a été
nécessaire de faire réagir l'alcoolate correspondant avec le B-lactame 5, précurseur
1
cyclique de la chaîne latérale. Finalement une étape de désllylation en C et sur la chaîne
latérale en milieu acide conduit au paclitaxel 1.
1) CISIEt,
2) Ac,O, Py
3a 4
1) LiHMDS, THF, - 40 C
2) HCI, CH, CN
Schéma 1 : Hémisynthèse du paclitaxel