Page 748 - Traité de chimie thérapeutique 6 Médicaments antitumoraux
P. 748
706 AUTRES ANTTTUMORAUX
sous sa forme native ou sous forme conjuguée à un polyéthylèneglycol de masse relative
5 000 (dénommée pégaspargase), et la L-asparaginase d'E. chrysanthemi (crisantas-
pase).
La structure primaire complète de la L-asparaginase extraite d'E. coli est connue
depuis une trentaine d'années, celle de l'enzyme extraite d'E. chrysanthemi a été établie
quelques années plus tard. Ces protéines sont des homotétramères constitués de quatre
sous unités possédant chacune un site catalytique. Le monomère précurseur est cons-
titué d'une séquence de 348 acides aminés ; sa masse relative est voisine de 37 000 Da.
Les séquences actives sont constituées de 321 acides aminés pour l'enzyme d'E. coli
et de 327 acides aminés pourcelle d'E. chrysanthemi. Elles présentent une grande homo-
logie structurale avec 143 acides aminés identiques et 43 résidus similaires.
La L-asparaginase appartient à la classe ATCC: L01X X02 et est répertoriée sous le
numéro [EC 3.5.1.1] de la classification enzymatique. Outre les dénominations indiquées
dans le tableau, les codifications suivantes lui ont été également attribuées : MK-965,
NSC-109229, Re-82-TAD 15.
2. VOIES D'ACCÈS
2.1. L-ASPARAGINASE
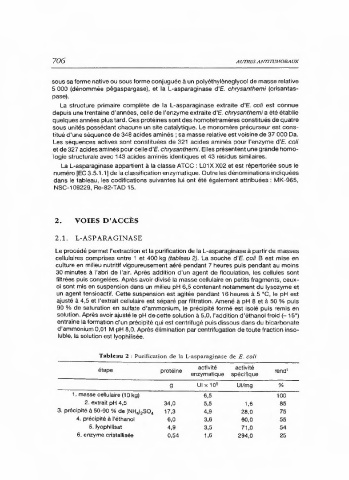
Le procédé permet l'extraction et la purification de la L-asparaginase à partir de masses
cellulaires comprises entre 1 et 400 kg (tableau 2). La souche d'E. coli B est mise en
culture en milieu nutritif vigoureusement aéré pendant 7 heures puis pendant au moins
30 minutes à l'abri de l'air. Après addition d'un agent de floculation, les cellules sont
filtrées puis congelées. Après avoir divisé la masse cellulaire en petits fragments, ceux-
ci sont mis en suspension dans un milieu pH 6,5 contenant notamment du lysozyme et
un agent tensioactif. Cette suspension est agitée pendant 16 heures à 5°C, le pH est
ajusté à 4,5 et l'extrait cellulaire est séparé par filtration. Amené à pH 8 et à 50 % puis
90 % de saturation en sulfate d'ammonium, le précipité formé est isolé puis remis en
solution. Après avoir ajusté le pH de cette solution à 5,0, l'addition d'éthanol froid (- 15°)
entraîne la formation d'un précipité qui est centrifugé puis dissous dans du bicarbonate
d'ammonium 0,01 M pH 8,0. Après élimination par centrifugation de toute fraction inso-
luble, la solution est lyophilisée.
Tableau 2 : Purification de la L-asparaginase de E. coli
activité activité
étape protéine rend'
enzymatique spécifique
g UIx 10° Ul/mg %
1. masse cellulaire (10 kg) 6,5 100
2. extrait pH 4,5 34,0 5,5 1,6 85
3. précipité à 50-90 % de (NH),SO, 17,3 4,9 28,0 75
4. précipité à l'éthanol 6,0 3,6 60,0 55
5. lyophilisat 4,9 3,5 71,0 54
6. enzyme cristallisée 0,54 1,6 294,0 25